高二化学第一学期半期试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
全卷总分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 N-14
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有1个选项符合题意)
1.下列物质不属于大气污染物的是( )
A.CO2 B.NO2 C.NO D.SO2
![]() 2.对于反应2CO(g)+
O2(g) 2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是( )
2.对于反应2CO(g)+
O2(g) 2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是( )
A.加压 B.再通入少量CO2 C.温度升高 D.容器容积扩大10倍
3.铜跟 1mol/L 的硝酸反应,若c(NO3—)下降 0.2mol/L,则c(H+)下降( )
A.0.2mol/L B.0.4mol/L C.0.6mol/L D.0.8mol/L
4.下列溶液一定呈酸性的是( )
A.pH小于7的溶液 B.含有H+离子的溶液
C.滴加酚酞显无色的溶液 D.c(H+)>c(OH-)的溶液
5.下列离子在溶液中能大量共存的是( )
A.NH4+、SO42—、NO3—、H+ B.I-、NO3—、H+、K+
C.NH4+、Cl-、OH-、NO3— D.Na+、H+、SO32—、SO42—
6.下列反应的离子方程式正确的是( )
A.钠与水反应:Na+2H2O==Na++2OH—+H2↑
B.向(NH4)2SO4溶液中滴加Ba(OH)2溶液:Ba2++SO42-==BaSO4↓
C.铜与稀硝酸反应:3Cu+2NO3—+8H+==3Cu2++2NO↑+4H2O
D.NH4Cl固体与固体烧碱混合共热:NH4++OH— ![]() NH3↑+H2O
NH3↑+H2O
7.反应mA(g) + nB(g) ![]() pC(g) + qD(s) ,测得平均反应速率v(C) == 2v(B),达到平衡后,若保持温度不变,缩小容器体积,平衡不移动。则m、n、p、q的数值可能分别为( )
pC(g) + qD(s) ,测得平均反应速率v(C) == 2v(B),达到平衡后,若保持温度不变,缩小容器体积,平衡不移动。则m、n、p、q的数值可能分别为( )
A.5、3、6、2 B.1、2、1、2 C.3、1、2、1 D.1、1、2、2
8.X、Y、Z 都是气体,下列反应在减压和升温时 Z 的含量都会升高的是( )
A.X + Y ![]() 2Z (正反应吸热)
B.2X + Y
2Z (正反应吸热)
B.2X + Y ![]() 2Z(正反应吸热)
2Z(正反应吸热)
C.X + 2Y ![]() 4Z (正反应吸热)
D.X + Y
4Z (正反应吸热)
D.X + Y ![]() 3Z (正反应放热)
3Z (正反应放热)
9.下图表示可逆反应mA(g)+nB(g)![]() pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )
pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )
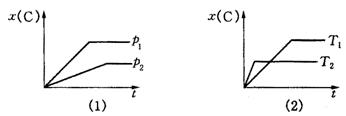
A.吸热反应,m+n<p B.吸热反应,m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
10.对可逆反应:A(g) + B(s) ![]() C(s) + D(g);(正反应吸热)。下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:( )
C(s) + D(g);(正反应吸热)。下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:( )
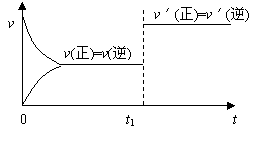 |
①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是
A.②③ B.①② C.③④ D.④⑤
11.在一定条件下,可逆反应 A(g)+ B(g) ![]() 2C(g)达到平衡的标志是 ( )
2C(g)达到平衡的标志是 ( )
①A、B、C的分子数比为1∶1∶2 ②A、B、C的浓度不再产生变化
③ 单位时间生成n摩尔 A,同时增加2n摩尔 C
④平衡体系中的压强不再发生变化
A.①② B.①④ C.②③ D.②④
12.一定条件下硝酸铵受热分解的未配平化学方程式为.NH4NO3 — HNO3 + N2 + H2O,
在反应中被氧化与被还原的氮原子数之比为 ( )
A.5∶3 B.5.∶4 C.1∶1 D.3∶5
13.改变以下反应的条件,能提高反应物活化分子百分率的是①温度②浓度③压强④正催化剂( )
A.①④ B.②③ C.①② D.③④
14.在容积相同的A、B两个密闭容器中,分别充入2 mol SO2和1
mol O2,使它们在相同温度下发生反应.2SO2+O2 ![]() 2SO3,并达到平衡,在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2的转化率应是
( )
2SO3,并达到平衡,在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2的转化率应是
( )
A.25% B.﹥25% C.﹤25% D.12.5%
15.pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是( )
A.11∶1 B.9∶1 C.1∶11 D.1∶9.
16.25℃时某溶液中由水电离出的c(OH-)为1×10-11mol/L,则该溶液的PH可能等于( )
①11 ②8 ③7 ④3
A ①④ B ①② C ①③ D ②③
17.相同温度下,c(H+)相同的硫酸、盐酸和醋酸物质的量浓度关系正确的是( )
A C(CH3COOH)>C(HCl)>C(H2SO4) B C(H2SO4 )>C(HCl )> C(CH3COOH)
C C(HCl)>C(H2SO4 )> C(CH3COOH) D C(HCl )> C(CH3COOH)> C(H2SO4 )
18.在一密闭容器中,反应aA(g) ![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A 平衡向正反应方向移动了 B 物质A的转化率小了
C 物质B的质量分数减小了 D a>b
19.将pH=5的盐酸溶液稀释1000倍后,溶液的pH为( )
A 等于8 B 等于7 C 略小于7 D 略大于7
20.若以w1和w2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) ( )
A.2w1=w2 B.w1=2w2 C.2w1<w2 D.w1<w2<2w1
21.常温下,以下4种溶液pH最小的是( )
A.0.01 mol·L-1醋酸溶液
B.0.02 mol·L-1醋酸与0.02 mol·L-1NaOH溶液等体积混合液
C.0.03 mol·L-1醋酸与0.01 mol·L-1NaOH溶液等体积混合液
D.0.02 mol·L-1醋酸与0.03 mol·L-1NaOH溶液等体积混合液
22.在一定条件下,可逆反应:N2 +3H2![]() 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,υ(正)、υ(逆)都发生变化且变化的倍数相等
B.加大压强,υ(正)、υ(逆)都增大,且υ(正)增大的倍数大于υ(逆)增大倍数
C.降低温度,υ(正)、υ(逆)都减少,且υ(正)减少的倍数小于υ(逆)减少倍数
D.充入氩气,υ(正)、υ(逆)都增大,且υ(正)增大的倍数大于υ(逆)增大倍数
23.将4mol A气体和2mol B气体在2L的密闭容器中混合并在一定条件下,发生反应:
2A(g)+B(g)![]() 2C(g),若经2秒后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g),若经2秒后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应平衡时的速率为0.3mol·L-1·s-1
②用物质B表示的反应平衡时的速率为0.6mol·L-1·s-1
③2s时物质A的转化率为30%
④2s时物质B的浓度为0.7mol·L-1
其中正确的是( )
A.①② B.①④ C.②③ D.③④
![]() 24.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
24.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
A. V(O2)=0.01mol.L-1.s-1 B. V(NO)=0.008mol.L-1.s-1
C. V(H2O)=0.006mol.L-1.s-1 D. V(NH3)=0.002mol.L-1.s-1
25.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
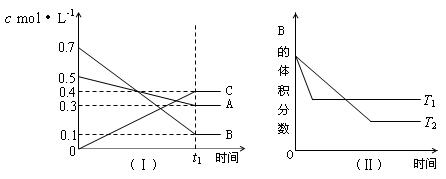
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总体积不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
第Ⅱ卷(非选择题,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | ||||||||||
| 题号 | 21 | 22 | 23 | 24 | 25 |
| ||||
| 答案 |
| |||||||||
二、填空题(本题共4小题,共30分)
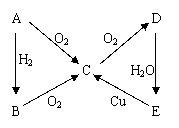 26.(8分)已知A、B、C、D、E五种物质中均为含有A元素,它们之间有如右图所示转化关系,请按要求回答有关问题:
26.(8分)已知A、B、C、D、E五种物质中均为含有A元素,它们之间有如右图所示转化关系,请按要求回答有关问题:
若A为气态非金属单质,按下列要求写出化学方程式
① Cu与E的浓溶液反应 : ______________________________
![]() ② B
C:______________________________
② B
C:______________________________
![]() ③ D
E: ______________________________
③ D
E: ______________________________
④ B和E反应: ______________________________
27.(10分)为了证明一水合氨是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.10 mol·L-1氨水、0.1 mol·L-1 NH4Cl 溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10 mol·L-1氨水pH为10, 则认定一水合氨是弱电解质,你认为这一方法是否正确?_________(填是或否),并说明理由:_________________________________________。
(2)乙取出10 mL 0.10 mol·L-1 氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足什么关系?______________________________(用等式或不等式表示)
(3)丙取出10 mL 0.10 mol·L-1 氨水,滴入 2 滴酚酞试液,显粉红色,再加入CH3COONH4晶体少量,颜色变(填“深”或“浅” )______________;你认为这一方法能否证明一水合氨是弱电解质?(填能或否)________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明一水合氨是弱电解质:_________________________________________________________________。
28.(4分)在高温下,下列反应达到平衡:
![]() C(s)+ H2O(g) CO(g)+H2(g) (正反应为吸热反应)
C(s)+ H2O(g) CO(g)+H2(g) (正反应为吸热反应)
(1)如果升高温度,平衡向 _______ 反应方向移动(填正或逆);
(2)如果增大压强,H2的体积分数将_______(填增大、减小或不变);
(3)如果通入水蒸汽,平衡向_______ 反应方向移动(填正或逆);
(4)如果加入焦炭,H2O的转化率将______(填增大、减小或不变)。
29.(8分)在一定条件下,x
A+y B![]() z C的反应达到平衡。
z C的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是________________;
(2)若加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热”)反应。
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不发生移动,则A是_____________(填“气态”或“固态”)物质。
(4)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则平衡一定向____________________(填“正反应方向”或“逆反应方向”)移动;
三、实验题
30.(10分)某课外活动小组在实验室用下图的一些装置组合后,快速制取
氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
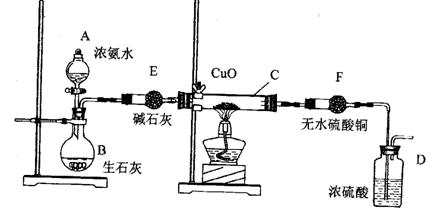
(1) 写出用熟石灰和氯化铵反应制氨气的化学方程式______________________________
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无色硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式:_________________,这个反应说明氨气具有______________(填编号:A、碱性 ;B、还原性;C、氧化性能; D、不稳定性)
(3) 洗气瓶中盛浓硫酸的主要作用是_________________
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置E的作用是_______________。装置F验证的气体是___________。
四、计算题(本题10分)
31.(4分)标准状况下,700L NH3溶于1L水中,所得溶液密度为0.90g/mL。求氨水的质量分数与物质的量浓度。
32.(6分)在密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2![]() 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为: c(NO2)
= 0.06 mol/L,
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为: c(NO2)
= 0.06 mol/L,
c(NO) = 0.24 mol/L。试求:
(1)NO2的转化率
(2)反应前后的压强比为多少?
(3)用O2来表示的反应速率是多少mol·L-1·min-1
高二化学半期试题答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | A | D | D | A | C | D | C | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | A | A | B | D | A | A | A | C | C |
| 题号 | 21 | 22 | 23 | 24 | 25 |
| ||||
| 答案 | A | D | D | D | C |
| ||||
三、填空题(本题共4小题,共30分)
26.(每空2分,共8分)① Cu+ 4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
②:4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
③ 3NO2+H2O===2HNO3+NO ④ NH3 +HNO3 ==== NH4NO3
27.(10分)(1) 是(1分) 常温下,对0.1 mol·L—1 NaOH溶液pH为13,而0.1 mol·—1
氨水pH为10(2分)
(2) a-b <2 (2分) (3) 浅(2分) 能 (1分)
(4) 取适量NH4Cl晶体溶于水,pH试纸测定溶液pH值小于7(2分)
28.(每空1分,共4分)(1) 正
(2) 减小
(3) 正 (4) 不变
29.(每空2分,共8分)
(1)x+y>z;(2) 放热 (3) 固态 (4) 逆反应方向
三、实验题
30、(共10分)
(1)
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
(2)2NH3+3CuO![]() N2+3Cu+3H2O(2分)
B (1分)
N2+3Cu+3H2O(2分)
B (1分)
(3)干燥N2(1分),除去过量NH3(1分)(4) C (1分) (5)干燥NH3 (1分) H2O(1分)
四、计算题(本题10分)
31.34.7%(2分),18.37mol/L(2分)
32、(1) 80% (2分)
(2)5:7(2分)
(3) 0.024mol·L-1·min-1(2分)