高二化学学业水平测试卷
说明:
1.本卷分Ⅰ、Ⅱ卷。Ⅰ卷为选择题,请把正确答案填涂在答题卡上;Ⅱ卷答案写在答题纸的相应位置。交卷时只交答题卡和答题纸。
2.考试时间:75分钟。本卷总分:100分。
3.本卷可能使用的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5
Ⅰ卷(共69分)
一、选择题(本大题包括17小题,每小题3分,共51分。每小题只有一个选项符合题意)
1.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.146C核素中的中子数为8 D.14CO2的摩尔质量为46
2.人们在认识事物时可以采取多种分类方法。下列关于Na2SO4的分类不正确的是( )
A.化合物 B.氧化物 C.钠盐 D.硫酸盐
3.有一首赞美某种气体的诗,其中的几句是:“她营造了云雾缭绕的仙景;她驱散了炎炎的暑气;她奋不顾身扑向烈火;她带给大地勃勃生机……。”这首诗所赞美的气体是
A.氧气 B.二氧化碳 C.氮气 D.甲烷
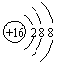 4.下列化学用语表达正确的是
4.下列化学用语表达正确的是
A.硫原子的结构示意图:
B.氯化氢分子的电子式:H+ [: :]-
C.乙烯的结构简式:CH2CH2
D.碳酸氢钠溶于水的电离方程式:NaHCO3==Na++HCO3-
|
A.2Na+2H2O ══ 2NaOH+H2↑ B.2Fe(OH)3══ Fe2O3+ 3H2O
C.SO2+H2O![]() H2SO3 D.Cu(OH)2+2HCl ══CuCl2+2H2O
H2SO3 D.Cu(OH)2+2HCl ══CuCl2+2H2O
6.如果要除去Na2CO3 固体中少量的NaHCO3,则应选择的最佳方法是
A.加入适量盐酸 B.加入NaOH溶液
C.加热灼烧 D.配成溶液后通入CO2
7.可以用铝制容器存放的物质是
A.稀硫酸 B.浓硝酸 C.浓盐酸 D.浓氢氧化钠溶液
8.下列物质的变化,不能通过一步化学反应完成的是( )
A. SiO2→H2SiO3 B. NO2→HNO3
C. NaOH→NaAlO2 D. CuCl2→FeCl2
9.下列实验方案能达到目的的是
A.除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B.实验室获取少量纯净的水:蒸馏自来水
C.提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
10.下列各组物质的性质比较,正确的是
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2 D.氧化性:F2 > Cl2 > Br2 > I2
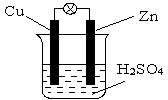 11.对右图所示的铜锌原电池,下列说法正确的是
11.对右图所示的铜锌原电池,下列说法正确的是
A.铜极是负极
B.铜片上有气泡产生
C.一段时间后,溶液的pH减小
D.一段时间后溶液的质量减轻
12.下列离子方程式书写不正确的是
A.常温下氯气与烧碱溶液反应:Cl2 + 2OH - ══ Cl- + ClO- + H2O
B.AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O ══ Al(OH)3↓+3NH4+
C.铜与稀硝酸反应:Cu + 2H+ ══ Cu2+ + H2↑
D.FeCl3溶液中加入KSCN:Fe3++3SCN一══Fe(SCN)3
13.下列叙述正确的是
A.根据HCl溶于水电离出H+和Cl-可判断:HCl为离子化合物
B.根据化学键的观点可推断:氮气常温下性质较活泼
C.根据丁达尔现象可区分:胶体和溶液
D.根据都能使有色物质褪色这一现象推断:氯水和SO2的漂白原理相同
14.海水淡化可采用膜分离技术。如右下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。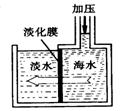 对加压后右侧海水成分变化分析正确的是
对加压后右侧海水成分变化分析正确的是
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
15.下列说法正确的是
A.化学反应中的能量变化,通常只表现为热量的变化
B.要使硫燃烧只需要大量的氧气
C.工业上常使用催化剂改变可逆反应的限度
D.SO2和O2合成SO3的反应中,升温增压,都可以提高反应的速率
16.检验溶液中是否含有某种离子,下列操作方法正确的是
A.加入AgNO3溶液,有白色沉淀生成,证明含有Cl-
B.加入BaCl2溶液,产生白色沉淀,证明有SO42-
C.加浓NaOH溶液后加热,产生使润湿的红色石蕊试纸变蓝色的气体,证明有NH4+
D.加入盐酸,放出能使澄清的石灰水变浑浊的气体,证明有CO32-
17.已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C、D、E有如下关系:

则下列推断不正确的是
A.鉴别A和甲烷可选择使用酸性高锰酸钾溶液
B.D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢
C.物质C的结构简式为CH3CHO,E的名称为乙酸乙酯
D.B+D→E的化学方程式为:CH3CH2OH+CH3COOH→CH3COOC2H5
二、选择题(本大题包括6小题,每小题3分,共18分。每小题只有一个选项符合题意)
 18.下列各类食物中蛋白质含量最丰富的是( )
18.下列各类食物中蛋白质含量最丰富的是( )



A. B. C. D.
19.食品疏松剂在受热时会产生气体,使食品内部形成均匀致密的海绵状多孔组织,让食品酥脆、疏松。下列物质可作为食品疏松剂的是
A.碳酸氢铵 B.碳酸钠 C.氢氧化铝 D.亚硫酸钠
20.下列关于药物的使用说法正确的是( )
A.因碘酒使蛋白质变性,故常用于外用消毒
B.使用青霉素时,直接静脉注射可以不用进行皮肤敏感试验
C.长期大量使用阿司匹林可预防疾病,没有副作用
D.能用于治疗胃酸过多的抗酸药通常含有麻黄碱
21.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。下列有关材料的说法中正确是
A.生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石
B.合金材料钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀
C.居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体
D.造成“白色污染”的聚氯乙烯塑料在日常生活中可用来进行食品包装
22.水对人类的生存具有非常重要的意义,没有水就不可能有生机勃勃的地球,所以保护水资源是人类共同的责任。下列各项能造成水质严重污染的是( )。
①生活污水的任意排放 ②海上油轮的原油泄漏 ③水力发电 ④农药化肥的不合理使用 ⑤使用无磷洗衣粉
A. 只有①②③ B. 只有①②④ C. 只有③⑤ D.只有②③⑤
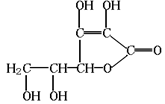 23.维生素C是一种水溶性维生素(其水溶液呈酸性)化学式为C6H8O6, 结构如右图所示。人体缺乏这种维生素C易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。下列关于维生素C的叙述不正确的是
23.维生素C是一种水溶性维生素(其水溶液呈酸性)化学式为C6H8O6, 结构如右图所示。人体缺乏这种维生素C易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。下列关于维生素C的叙述不正确的是
A.维生素C能使溴水褪色 B.维生素C可作食品添加剂
C.维生素C可发生水解反应 D.维生素C不能发生氧化反应
Ⅱ卷(共31分)
三、(本大题包括2小题。共11分)
24.(5分)现有下列五种物质 A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素,请按下列要求填空(填序号)。
富含维生素C的是 ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;既可作为调味剂,又可作为防腐剂的是 ;食用过多会引起血压升高、肾脏受损的 。
25.(6分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式: 。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是
。
(3)控制城市空气污染源的方法可以有 (多选)
A. 开发新能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具
四、(本大题包括3小题。共20分)
26.(6分)氯是一种海水富集元素。下图是一套制取并验证氯气部分化学性质的实验装置:
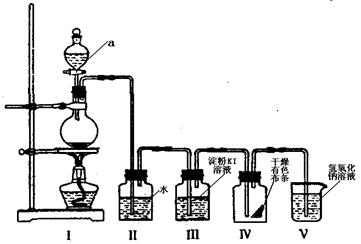
回答下列问题:
(1)装置I中,仪器a的名称叫________。
(2)当Cl2气流通过一段时间后,装置Ⅱ中溶液的pH值____7(填“>”“<”或“=”)
(3)当有少量Cl2气流通过后,装置Ⅲ中反应的离子方程式为________ 。
(4)当Cl2气流持续通过时,装置Ⅳ中干燥的有色布条能否褪色? 。
(5)装置V的作用是________________________________。
27.(9分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
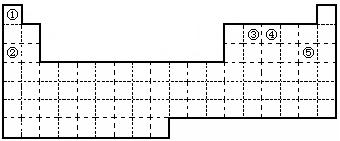
(1)上述五种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中燃烧的化学方程式为 。
(2)元素①和③可以形成众多的化合物,其中最简单的是(写化学式) ,
该化合物中,化学键的类型为 (填“离子键”或“共价键”)。
(3)试用单线桥法表示元素④最高氧化物的水化物与Cu反应过程中电子转移的数目和方向 ,该反应中作氧化剂的是(写化学式) 。
(4)试用电子式表示元素⑤单质分子的形成过程 。
28.(5分)右图为某市售盐酸试剂瓶标签上的部分数据。通过计算回答:
|
此盐酸?(水的密度以1.00g/cm3计)
(2)该盐酸25.4mL与2.00 mol·L-1的NaOH溶液100mL混合,
再将混合后溶液稀释至1.00L,此时溶液中氢离子的物质的量
浓度约为多少?
化学学业水平测试
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | B | B | D | A | C | B | A | B | D | B | C | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |||
| 答案 | B | D | C | D | D | A | A | B | B | D |
24.C D E B A
25.(1) 2CO+2NO=CO2+N2 (2) SO2→SO3→H2SO4 (3)AB
26.(1)分液漏斗;浓盐酸(2)< ,(3)Cl2 + 2I- === I2 + 2Cl-
(4)能褪色,因氯气通过C中的溶液会变成润湿的氯气,这样就能使有色布条褪色。
(5)吸收未反应的氯气,防止污染空气。
27.(1)第三周期第IA主族 (2)CH4 共价键 (3)方程式略 HNO3 (4)略
28.(8分)
解:
|
![]() (VHCl / 22.4L · mol-1)×36.5g · mol-1 +
1000g
(VHCl / 22.4L · mol-1)×36.5g · mol-1 +
1000g
V(HCl )= 353 L 2分
(2)此盐酸的物质的量的浓度为
 |
C(HCl) = = 11.8mol · L-1
1分
与NaOH溶液混合后溶液中的氢离子浓度为:
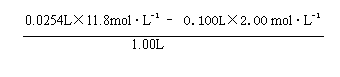
C(H+ )= ≈0.100 mol · L-1
2分
(注:如没有带单位列式运计算或没保留有效数字总扣1分。其它方法做对同样得分)
学业水平测试模拟双向细目表
| 题号 | 题型 | 考点考纲要求 | 分值 | 备注 |
| 1 | 选择题 | 1.知道元素、核素、同位素、质量数的涵义。(A) | 3 | 化学2主题1 |
| 2 | 选择题 | 5.认识化学变化的本质。(B) | 3 | 1-1-5 |
| 3 | 选择题 | 二氧化碳 | 3 | 初中 |
| 4 | 选择题 | 3.能画出1~18号元素的原子结构示意图。(B) 14.能写出结构简单的常见原子、离子、分子、离子化合物的电子式,能够用电子式表示结构简单的常见离子化合物、共价分子的形成过程。(B) | 3 | 2-1-3 2-1-14 |
| 5 | 选择题 | 12.了解比较、分类等科学方法是化学研究和学习的常用方法。(AⅠ) | 3 | 1-1-12 |
| 6 | 选择题 | 13.掌握鉴别碳酸钠和碳酸氢钠的方法。(Dc) | 3 | 1-3-13 |
| 7 | 选择题 | 33.了解二氧化硫与氧气、与水的反应,认识亚硫酸的不稳定性,认识二氧化硫的漂白作用与次氯酸漂白作用的区别,了解二氧化氮与水的反应,了解二氧化硅与氢氟酸、与碱性氧化物、与强碱的反应。(B) | 3 | 1-1-33 |
| 8 | 选择题 | 35.了解次氯酸、浓硫酸、硝酸的强氧化性,了解浓硫酸、硝酸分别与Cu、C的反应。了解常温下铁、铝在浓硫酸、浓硝酸中的钝化现象。(删去认识工业上生产硫酸、硝酸的反应原理。)(B) | 3 | 1-1-35 |
| 9 | 选择题 | 5.初步学会使用过滤、蒸发等方法对混合物进行分离和提纯。(Bb) 6.初步学习蒸馏、萃取等分离和提纯的方法。(Aa) | 3 | 1-2-5 1-2-6 |
| 10 | 选择题 | 8.知道金属、非金属在元素周期表中的位置及其性质的递变规律。(A) | 3 | 2-1-8 |
| 11 | 选择题 | 5.通过制作简易原电池的实验,了解原电池的概念和原理。(B) | 3 | 2-2-5 |
| 12 | 选择题 | 20.通过实验事实认识离子反应及其发生的条件,能正确书写常见的离子方程式。(B) | 3 | 1-3-20 |
| 13 | 选择题 | 6.了解胶体的重要应用。(A) 16.以海水、金属矿物等自然资源的综合利用为例,了解化学方法在实现物质间转化中的作用。(BⅠ) | 3 | 1-3-6 2-3-16 |
| 14 | 选择题 | 16.以海水、金属矿物等自然资源的综合利用为例,了解化学方法在实现物质间转化中的作用。(BⅠ) | 3 | 2-3-6 |
| 15 | 选择题 | 6.认识提高燃料的燃烧效率、开发高能清洁燃料和研制新型电池的重要性。(BⅡ) 7.通过实验认识化学反应的速率。(B) 8.通过实验认识化学反应的限度。(B) | 3 | 2-2-7 |
| 16 | 选择题 | 21.初步学会Cl-、SO42-、CO32-、Al3+、Fe3+、NH4+等常见离子的检验方法。(Db) | 3 | 1-3-21 |
| 17 | 选择题 | 12.了解乙酸的酸性、酯化反应等性质及主要用途。(B) | 3 | 2-3-12 |
| 18 | 选择题 | 4.知道哪些常见食物中富含蛋白质和氨基酸。(A) | 3 | 3-1-4 |
| 19 | 选择题 | 13.知道几种常见的食品添加剂的组成、性质、作用和合理使用。(AⅠ) | 3 | 3-1-13 |
| 20 | 选择题 | 14.通过实例了解某些药物的主要成分和疗效。(BⅠ) | 3 | 3-1-14 |
| 21 | 选择题 | 5.知道主要的居室空气污染物。(A) 9.认识防止金属腐蚀的重要意义。(BⅡ) 10.知道常用的硅酸盐材料(水泥、玻璃和陶瓷)的主要化学成分、生产原料及其用途。(A) | 3 | 3-3-5 3-2-9 3-2-10 |
| 22 | 选择题 | 1.通过典型实例,了解水污染造成的危害。(BⅡ) | 3 | 3-3-1 |
| 23 | 选择题 | 6.知道维生素C的组成、结构和重要性质。(A) | 3 | 3-1-6 |
| 24 | 填空 | 13.知道几种常见的食品添加剂的组成、性质、作用和合理使用。(AⅠ) 5.知道常见的几种维生素及其主要来源、摄入途径。(A) 14.通过实例了解某些药物的主要成分和疗效。(BⅠ) | 5 | 3-1-13 3-1-5 3-1-14 |
| 25 | 填空 | 4.知道减少或消除大气污染物的原理和方法。(A) | 6 | 3-3-4 |
| 26 | 实验填空 | 9.探究氯气及其化合物的性质 | 6 | 化学1 实验9 |
| 27 | 填空 | 7.认识元素在周期表中的位置与其原子的电子层结构的关系。(B) 10.认识化学键的涵义。(B) 14.能写出结构简单的常见原子、离子、分子、离子化合物的电子式,能够用电子式表示结构简单的常见离子化合物、共价分子的形成过程。(B) 25.能配平简单的氧化还原反应方程式,学会用单线桥、双线桥表示电子转移的方向和数目。(B) | 2 2 3 2 | 2-1-7 2-1-10 2-1-14 1-3-25 |
| 28 | 计算 | 8.了解物质的质量、摩尔质量、物质的微粒数、物质的量、气体摩尔体积、物质的量浓度等物理量之间的关系,能用它们进行简单的化学计算。(B) | 5 | 1-1-8 |
认知水平考点小计
| 认知水平 | A | B | C | D | 初中 |
| 知识点 | 14个 | 约22个 | 0 | 2 | 1个 |
| 分值 | 约37分 | 约58分 | 0分 | 6分 | 3分 |
| 总知识点数 | 86(27有机) | 97(17有机) | 9(3个有机) | 5个 |
|
说明:少数选择题涉及到几个知识点
建议:认知水平中C、D级的考点,几乎每年会考必考,建议适当加些试题。
模块考点小计
| 模块 | 化学1 | 化学2 | 化学与生活 |
|
| 考点 | 12 | 12 | 12 |
|
| 分值 |
|
|
|
|
说明:知识点分布均衡,象会考题送分的题目偏少些
建议:换4-5题,一看就能拿分的试题。