高二化学上期半期测试题
本试题分两部分,第一部分为选择题,第二部分为非选择题;共27小题。
可能用到的相对原子量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 Cu 64
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意,将正确选项填在后面的答题卡内)
1.下列气体既可以用浓硫酸干燥,又能用P2O5或碱石灰干燥的是
A. SO2 B.Cl2 C.NH3 D.N2
2.将pH值相同的盐酸和醋酸稀溶液,分别用蒸馏水稀释至原体积时m倍和n倍后,两溶液的pH值仍然相同,则m和n的关系是
A.m<n B.m>n C.m=n D.无法确定
3.下列说法中正确的是
A.氮元素是活泼的非金属元素,因此其单质的化学性质也很活泼
B.二氧化氮溶于水生成硝酸,因此二氧化氮是硝酸的酸酐
C.雷雨时,可增加土壤中硝酸盐类氮肥的变化属于氮的固定
D.氨气可作焊接金属的保护气
4.改变条件既能提高单位体积内的活化分子数,又能提高活化分子百分数的是
A.增大反应物的浓度 B.增加气体压强 C.升温 D.增大反应物的物质的量
5.反应A(g)+3B(g)
![]() 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A.V(C)= 0.04 mol /(L·S) B.V(B)= 0.06 mol /(L·min)
C.V(A)= 0.15 mol /(L·min) D.V(D)= 0.01 mol /(L·S)
6.关于磷的下列叙述中,正确的是
A.白磷没有毒性而红磷有剧毒 B.红磷在氯气中燃烧产生白色的烟雾
C.白磷在空气中加热到260℃可转变为红磷 D.白磷可用于制造安全火柴
7.已知氨水浓度越大,密度越小,例如,若将标准状况下380体积NH3溶于1体积水中,所得氨水密度约为0.92 g·cm-3。若将质量分数为a%的浓氨水与等体积水混合,所得稀氨水的质量分数一定是(设混合中NH3和水均无损耗)
A.大于0.5a% B.小于0.5a% C.等于0.5a% D.仍为a%
8.下列物质的水溶液能导电但该物质为非电解质的是( )
A. Cl2 B. HF C. NH3 D.CH3COOH
9.某酸HA的下列性质中,可以证明它是弱电解质的是
A. HA溶液的导电能力比盐酸弱
B. HA能溶与水
C.10ml 1mol/L HA能于等体积等浓度的NaOH溶液恰好反应
D. 0.1 mol/LHA溶液的pH约为3
10.20℃时,H2S的饱和溶液,浓度约为0.1mol/L,其电离方程式为:第一步 H2S ![]()
H+ + HS─;第二步 HS─ ![]() H+ + S2─。若要使该溶液的pH增大的同时,c(S2─)减小,可采用的措施是①加入适量的NaOH溶液;②加入适量的水;③通入适量的SO2; ④加入适量硫酸铜固体;⑤加入少量盐酸
H+ + S2─。若要使该溶液的pH增大的同时,c(S2─)减小,可采用的措施是①加入适量的NaOH溶液;②加入适量的水;③通入适量的SO2; ④加入适量硫酸铜固体;⑤加入少量盐酸
A.①③⑤ B.②④⑤ C.②③ D.③④⑤
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意,将正确选项填在后面的答题卡内)
11.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同 B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深 D.反应中转移的电子总数:前者多,后者少
12.6.4克铜与一定量的浓硝酸恰好完全反应,生成的气体被饱和氢氧化钠溶液完全吸收,生成NaNO3和NaNO2,则亚硝酸钠的物质的量为
A.0.2mol B.0.3mol C.0.1mol D.0.5mol
13.现有下列试剂:①氯水 ②溴水 ③碘水 ④O3 ⑤NO2 ⑥稀硝酸,其中能使淀粉碘化钾溶液变蓝的是
A.①②⑥ B.④⑤ C.除③外 D.全部
14.一定温度下,可逆反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A. 单位时间内生成 n mol A2,同时生成 n mol AB
B. 体系内的总压不随时间变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成 n mol A2的同时,生成n mol B2
15.在一定条件下,密闭容器中发生如下的反应:2SO2(g)+O2(g)![]() 2SO3(g),正反应是放热反应。反应达平衡后,已知SO2、O2、SO3的物质的量之比为3︰2︰5。其它条件不变,升温后,达到新的平衡时,已知SO2、O2的物质的量分别为1.4mol和0.9mol,则此时容器内SO3的物质的量应为
2SO3(g),正反应是放热反应。反应达平衡后,已知SO2、O2、SO3的物质的量之比为3︰2︰5。其它条件不变,升温后,达到新的平衡时,已知SO2、O2的物质的量分别为1.4mol和0.9mol,则此时容器内SO3的物质的量应为
A. 1.8mol B. 2mol C. 2.2mol D. 2.4mol
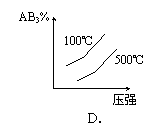
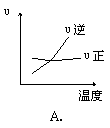
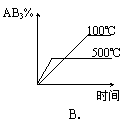
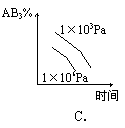
16.对于可逆反应 2AB3(g) ![]() A2(g) + 3B2(g)(逆反应是放热反应),下列图像不正确的是
A2(g) + 3B2(g)(逆反应是放热反应),下列图像不正确的是
 | |||||||
 | |||||||
 |  | ||||||
17.一定条件下,可逆反应X(g) + 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、
2Z(g),若X、Y、Z起始浓度分别为c1、c2、
c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,
则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
18.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A.滴加石蕊试液显红色的溶液 Fe3+ 、NH4+ 、Cl- 、I-
B.pH值为1的溶液 Cu2+、Na+ 、Mg2+、NO3—
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3—、Br-、Ba2+
D.所含溶质为Na2SO4的溶液 K+ 、CO32—、NO3—、Ca2+
19.在室温下,等体积的酸和碱溶液混合后,pH一定小于7的是
A.pH=3的HNO3与pH=11的KOH溶液
B.pH=3的盐酸与pH=11的氨水
C.pH=3的硫酸与pH=11的NaOH溶液
D.pH=3的醋酸与pH=11的Ba(OH)2溶液
20.为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg![]() . 下列叙述正确的是
. 下列叙述正确的是
①任何温度下,水的AG等于0
②溶液的AG越小,酸性越强
③常温下,0.1mol·![]() 盐酸的AG=12
盐酸的AG=12
④25℃时,某溶液的AG=-10,其pH=10
A.①② B.②④ C.①③ D.③④
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 第一题分数 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 第二题分数 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
三、实验题(本题只有1小题,共13分)
21.下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
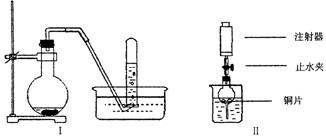
(1)铜与稀硝酸反应的离子方程式____________________________。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体______________(填“能”或“不能”),简述理由________________________________________。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则:检查气密性的操作是___________________________________________________________
______________________________________________________________________。
在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象_____________________________________________________
_____________________。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是__________________________。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是___________
______________________。
四、填空题(本题有5小题,共30分)
22.(5分)某无色混合气体中可能含有N2、O2、Cl2、HCl、NH3、NO、NO2中的两种或多种气体,现将此混合气体通过浓硫酸后,气体体积明显减小,当剩余气体与空气接触时,立即变为红棕色,则原混合气体中一定含有的气体是 ,一定不存在的气体是 ,可能存在的气体是 。
23.(4分)A、B、C、D均为中学化学常见的物质,已知A是可溶性强碱,B是正盐,D不溶于稀硝酸它们间的反应关系如下图所示。
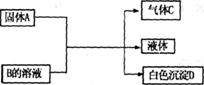
(1)简述实验室检验气体C的方法
(2)写出A、B的化学式A B
24.(8分)(1)简述PH试纸的使用方法
(2)现有①硫酸溶液、②醋酸溶液、③盐酸三种溶液
A:当pH值相等时,三种酸的物质的量浓度由大到小的顺序是(用①②③表示)__________。
B:当物质的量浓度相等时,三种酸溶液的pH值由小到大的顺序是(用①②③表示)_________。
C:取pH值都等于3的①②③三种溶液各100mL,分别向其中加入10mLpH=12的Ba(OH)2,溶液,反应后pH值最小的是___________。
25.(8分)在某一容积为VL的密闭容器内,加入等物质的量的X和Y,在一定的条件下发
生如下反应:X(g)+Y(g)![]() 2Z
(g)。(正反应是放热反应)(1)反应达到平衡后,若降
2Z
(g)。(正反应是放热反应)(1)反应达到平衡后,若降
低温度,化学反应速率 ,Z的浓度 。(填“增大”、“减小”或“不变”)。
(2)图1、图2表示该反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线:
|
|
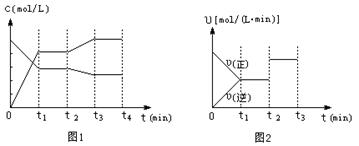
由图1判断,反应进行至t2 min时,曲线发生变化的原因是 (用文字表达)。由图2判断,t2 min到t3 min 的曲线变化的原因可能是 (填编号)
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
26.(5分)在一定温度下, 1molN2和3molH2发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g)(正反应是放热反应)
2NH3(g)(正反应是放热反应)
(1)若在起始体积都是1L的定压密闭容器中和定容密闭容器中建立反应,先达到平衡的
是 密闭容器, H2的转化率高的是 密闭容器(填定压或定容)
(2)若在上述定压容器中反应达到平衡时,平衡混和物中NH3的体积分数是a。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使反应达到平衡后平衡混和物中NH3的体积分数同样是a。则x、y、z满足的条件是 。
四、计算题(本题只有1小题,共7分)
27.已知: 4NH3十5O2 = 4NO+4H2O 4NO十3O2十2H2O = 4HNO3 。设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
(1)amolNO完全转化为HNO3需要氧气_______ mol
(2)为使NH3恰好完全氧化为一氧化氮,氨和空气混合物中氨的体积分数为________。
(3) 20.0mol 的NH3和一定量空气充分反应后,再转化为HNO3。
设HNO3的物质的量是X moL,空气的物质的量是Y mol。写出当125≤Y≤ 200时,X和Y的关系式_________________________________。
高二化学半期测试题答案
选择题答案(1到10题每小题2分;11到20题每小题3分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | C | C | A | B | B | C | D | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | D | C | A | A | C | B | D | C |
三、实验题(本题只有1小题,共13分)
21.(1) 3Cu + 8H+ +2 NO3— = 3Cu2+ + 2NO↑+ 4H2O 2分
(2)不能(1分);如Cu与稀HNO3反应生成NO2通过排水法只能收集到NO 2分
(3)按图连接好仪器,烧杯中加适量的水,然后向外抽拉注射器活塞使干燥器内液面高于烧杯中的液面,后固定注射器活塞,若液面高度差不改变,则证明装置不漏气。 2分
Cu与稀HNO3剧烈反应,溶液变蓝,液面下降,有无色气体生成。 2分
注射器内气体由无色变红棕色。 2分
(4)防止氮的氧化物污染环境。 2分
四、填空题(本题有5小题,共29分)
22. NH3,NO 2分
HCl,NO2,O2,Cl2 2分
N2 1分 (该题有错不给分)
23.(1)用玻璃棒沾湿润的红色石蕊试纸接触气体C,如试纸变蓝,则证明是NH3 。2 分
(2)A :Ba(OH)2 1 分 B:(NH4)2SO4 1分
24.(1)取一张PH试纸放于洁净的玻璃片上,然后用洁净的玻璃棒沾取试液点试PH试纸中部,半分钟后与标准比色卡对照读出PH值。 2分
(2)A: ②③① 2分 B: ①③② 2分 C: 2分(该题有错不给分)
25.减小,增大 4分
t2 时对平衡体系降温 2分 b d (有错不给分2分
26.(1)定压 1分 定压 1分
(2)x:y=1:3 ,z≥0 ,x,y,z不同时为0 (有错不给分) 3分
四、计算题(本题只有1小题,共7分)
27.(1)0.75a 2分
(2)0.14 2分
(3) X=0.8(Y-125)/3 3分