高二化学上第二次阶段考试试题
化 学 试 题
第Ⅰ卷(选择题,共69分)
可能用到的相对原子质量:H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 A1-27 S—32 C1-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137
一、选择题(每小题只有一个选项符合题意)
1. 人的纯净的胃液是一种强酸性液体,pH在0.9~1.5之间,氢氧化铝是一种治疗胃酸过多的胃药的主要成分.目前这种胃药已不常用,原因主要是( )
A 长期摄入铝元素不利于人体健康 B 它不能中和胃酸
C 它不易溶于胃液 D 它的疗效太差
2.在面盆、痰盂等铁制品表面烧制搪瓷的目的是( )
A、防止铁生锈且美观 B、增大厚度防止磨损
C、增大硬度防止撞坏 D、美观和杀菌消毒作用
3.国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”。我国政府即将启动“酱油补铁工程”。这里的铁是指( )
A、铁单质 B、铁元素 C、四氧化三铁 D、硫酸铁
4.2005年下半年,我国接连发生多起煤矿爆炸事故,造成重大人员伤亡和财产损失。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是( )
A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子
B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子
C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业
D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
5.锌锰干电池放电时电池总反应式:Zn+2MnO2+2NH4+ Zn2++Mn2O3+2
NH3+H2O在此电池放电时,正极(碳棒)上发生反应的物质是( )
A.Zn B.碳棒 C.MnO2和NH4+ D.Zn2+和NH4+
6.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
7.有机物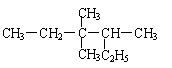 的正确命名为( )
的正确命名为( )
A.2-乙基-3,3-二甲基戊烷 B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷 D.3,4,4-三甲基己烷
8.等量镁铝合粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A. 2 mol·L-1 H2SO4溶液 B. 18 mol·L-1 H2SO4溶液
C. 6 mol·L-1 KOH溶液 D. 3 mol·L-1 HNO3溶液
9.下列实验中,溶液颜色有明显变化的是( )
A. 少量明矾溶液加入到过量NaOH溶液中
B. 往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C. 少量Na2O2固体加入到过量NaHSO3溶液中
D. 往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
10.一定能在下列溶液中大量共存的离子组是( )
A. 含有大量Al3+的溶液:Na+、![]() 、
、![]() 、Cl-
、Cl-
B. c(H+)=1×10-13 mol·L-1的溶液:Na+、Ca2+、![]() 、
、![]()
C. 含有大量Fe3+的溶液:Na+、Mg2+、![]() 、SCN-
、SCN-
D. 含有大量NO3-的溶液:H+、Fe2+、![]() 、Cl-
、Cl-
11.氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可供航天员饮用,其电极反应:负极:2H2+4OH--4e-====4H2O 正极:O2+2H2O+4e-====4OH-
当得到1.8L饮用水时,电池内转移电子物质的量约为( )
A.1.8mol B.3.6mol C.100 mol D.200mol
12.
甲、乙、丙、丁分别是![]() 、
、![]() 、NaOH、
、NaOH、![]() 四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.![]() B.NaOH C.
B.NaOH C.![]() D.
D.![]()
13.一种新型的灭火剂叫“1211”,其分子式是CF2ClBr。命名方法是按碳、氟、氯、溴的顺序分别以阿拉伯数字表示相应元素的原子数目(末尾的“0”可略去)。按此原则,对下列几种新型灭火剂的命名不正确的是( )B
A.CF3Br ─ 1301 B.CF2Br2 ─ 122
C.C2F4Cl2 ─ 242 D.C2ClBr2 ─ 2012
14.室温下,1体积气态烃和一定量的氧气混合并充分燃烧后, 再冷却至室温,气体体积比反应前缩小了3体积,则气态烃是( )AD
A.C3H8 B.C4H10 C.C5H12 D.C2H6
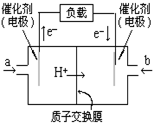 15.如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
15.如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
2CH3OH+3O2=2CO2+4H2O。
下列说法中正确的是( )
A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
16.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:
Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
17. 向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A.3.45 g B.2.3 g C.1.15 g D.0.575 g
18.蛇纹石由MgO、A12O3、Si02、Fe203组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加人NaOH溶液至过量。下列叙述不正确的是( )
A.沉淀X的成分是Si02
B.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
C.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3,
D.在溶液Y中加人过量的NaOH溶液,过滤,得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
19.实验室制备硝酸铝[AI(NO3)3·9H20]可使用下列方法:
![]()
下列说法或反映上述有关反应的离子方程式错误的是( )
A.制备过程中加HNO3应该过量,以防止蒸发时Al(NO3)3水解
B.不直接用铝片跟稀硝酸反应制硝酸铝主要是因为铝在稀硝酸中发生钝化
C.Al(OH)3沉淀不溶于NH4Cl
D.3H++Al(OH)3=A13+ +3H2O
20.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.14mol B.0.16mol C.0.21mol D.0.24mol
21.C8H18中含4个-CH3且存在1个C原子不与H相连接的结构有( )种
A.1 B.2 C.3 D.4
22.2.1g镁铝合金完全溶于足量盐酸,生成氢气2.24L(标准状态下),再向溶液中加入氢氧化钠溶液,生成沉淀的质量最大的是( )
A.2.9g B.4.6g C.5.5g D.6.9g
23.将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为( )
A.11.20L B.15.68L C.22.40L D.31.36L
安溪一中08届高二(上)第二次阶段考试
化 学 试 题
第II卷(非选择题,共31分)
说明:第II卷所有答案均填在答题卡上,答在试卷上的答案均无效。
可能用到的相对原子质量:H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 A1-27 S—32 C1-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137
24.(6分)已知铁溶于一定浓度的硝酸溶液中反应的离子方程式为(系数a~k均为正整数):aFe+bNO3—+cH+→dFe2++fFe3++gNO↑+hN2O↑+kH2O。回答下列问题:
(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是
(用一个代数式表示,下同。):____________________________ ___
;
(2)根据反应中离子的电荷守恒,可得b、c、d、f的关系式是:__________________
;
(3)根据反应中电子转移的总数相等,可得d、f、g、h的关系式是:______________
;
25.(6分)下列框图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质,Y是一种无色液体,既可作氧化剂,又可作还原剂,B、X均为气体单质,D属于可溶于水的强电解质,一个D分子含有18个电子。
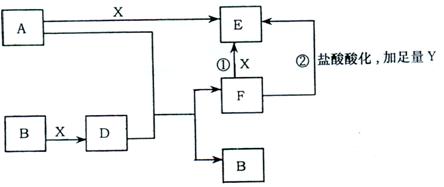 |
(1) A原子最外层有 个电子;
(2)写出反应①的化学方程式: ;
(3)写出反应②的离子方程式: 。
26.( 4分)某同学猜测,铝热反应所得到的熔融物是铁铝合金。
(1)根据已有知识找出一种验证产物中有Fe的最简单方法:
;
(2)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝。(只用反应离子方程式表示): 。
27.(6分)在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如右图所示。
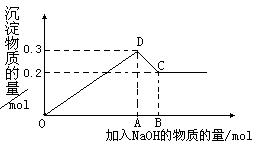
(1)图中线段OA∶AB= ;
(2)若得到0.25 mol的沉淀,则加入NaOH物质的量为 。
28. (3分)不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔解的K2CO3,已知该电池的总反应为:2H2+O2===2H2O,负极反应为:H2+CO32――2e-==H2O+CO2,正极反应式为:
;
29.(6分)由A、B两种有机物组成的混合物,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
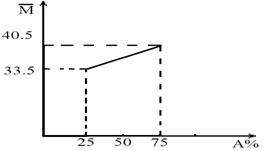
(1)A的相对分子质量为___ ______。
(2)若混合物为烷烃,则分子式分别为_____ ____、______ __;
化 学 试 题参考答案
选择题每题3分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 答案 | A | A | B | B | C | C |
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | A | B | A | D | D |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | A | B | B | C | B |
| 题号 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | B | C | B | C | A |
24.(6分)(1)c=4g+10h (2)c—b=2d+3f(3)2d+3f=3g+8h
25.(6分)(1)2 (2)① 2FeCl2+Cl2=2FeCl3
(3)② 2Fe2++H202+2H+=2Fe3++2H20
26.(4分)(1)用磁铁吸引,若能吸附,说明有铁生成
(2)2A1+2OH-+2H2O=2AlO2-+3H2↑
27.(6分)(1)7∶1 (2)0.45 mol或0.75 mol
28.(3分) O2+ 2CO2+4e-==2 CO32―
29.(6分)⑴44 ⑵C3H8、C2H6 ;