高二化学下学期期中考试试题
高二化学试题
(时量:90分钟 满分:108分)
说明:1、第I卷54分,第Ⅱ卷54分,选择题答案请填到答题区表内
2、可能用到的原子量:H 1 O 16 C 12 S 32 N 14 Cl 35.5
Cu 64 Na 23 P 31 Fe 56
第I卷(共54分)
一、选择题(每题3分,18个小题,共54分,每小题只有一个正确答案)
1.以下叙述中不正确的是
A.氮族元素是位于周期表中第ⅤA族元素
B.氮族元素的最高正价与最低负价的绝对值之差等于2
C.硝酸是一种不稳定的强酸,具有强氧化性
D.王水是浓硝酸和浓盐酸(体积比3﹕1)的混合物
2.在NO2与水的反应中,NO2是
A、只是氧化剂 B、只是还原剂
C、既是氧化剂,又是还原剂 D、既不是氧化剂,又不是还原剂
3.在通常情况下能共存,且均可用浓硫酸干燥的气体组是
A.H2、H2S、SO2 B.NH3、CO2、HCl C.N2、Cl2、CO2 D.NO、CO2、O2
4.下列关于浓HNO3和浓H2SO4的叙述,正确的是
A、都不易分解 B、露置在空气中,容器内溶液的质量都减小
C、常温下都能与铜较快反应 D、露置在空气中,容器内溶液的浓度都减小
5.下列说法中正确的是
A.非金属氧化物都是酸性氧化物
B.金属氧化物都是碱性氧化物
C.将氨转变成硝酸或其它氮的化合物称为固氮
D.N2性质稳定,是因为N2分子中氮氮叁键键能很大
6.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物.当参加反应的单质与被
还原硝酸的物质的量之比为2:1时,还原产物是( )
A NO2 B NO C N2O D N2
7.常温常压下将等体积的NO和O2混和,混合气体的平均式量为
A.31 B.小于41.3 C.等于41.3 D.大于41.3
8.在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g)
![]() C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.反应混合物总质量 D.气体的总物质的量
9.右图曲线a表示放热反应 X(g) + Y(g) ![]() Z(g)
Z(g)
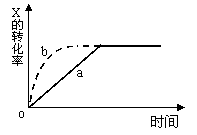 + M(g) + N(s)进行过程中X的转化率随时间变化的
+ M(g) + N(s)进行过程中X的转化率随时间变化的
关系。若要改变起始条件,使反应过程按b曲线进行,
可采取的措施是
A、 升高温度
B、 加大X的投入量
C、加催化剂
D、增大体积
10.在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、
v(C)(mol·L-1·s-1)表示且v(A)、v(B)、v(C)之间有以下关系:
v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为
A.2A+3B![]() 2C B.A+3B
2C B.A+3B![]() 2C
2C
C.3A+B![]() 2C
D.A+B
2C
D.A+B![]() C
C
11.有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z(g),ΔH<0(正反应放热)。为了使
2Z(g),ΔH<0(正反应放热)。为了使
平衡向生成Z 的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤C.②③⑥ D.②④⑥
12.某硝酸盐R(NO3)2受热分解为RO、NO2和O2,将生成的气体充满一干燥烧瓶(标准状况)
再将烧瓶倒置于水中,当液面不再上升时,烧瓶中溶质的物质的量浓度为
A.0.8 mol/L B.1/28 mol/L C.1/14 mol/L D. 1/22.4mol/L
13.在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1∶3的N2和H2。
若开始时两容器的体积相等,且在相同条件下达到平衡时,两容器中N2的转化率应当
是
A.a中大 B.b中大 C.a、b中一样大 D.无法判断
14.在常温常压下,向10mL 0.01mol/L FeCl3溶液中滴入1mL 0.01mol/L KSCN溶液,可
发生反应FeCl3+3KSCN ![]() 3KCl+Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移
3KCl+Fe(SCN)3,达到平衡后溶液显红色,能使平衡逆向移
动的条件是( )
A、向溶液中加少量KCl晶体 B、向溶液中加入少量水
C、向溶液中滴入数滴 1mol/L FeCl3 D、设法移走部分水
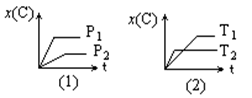 15.右图表示可逆反应mA(g) + nB(g)
15.右图表示可逆反应mA(g) + nB(g) ![]() pC(g)
pC(g)
在不同温度(T)、压强(P)下,生成物C的物质
的量分数x(C)的变化情况。下列关于该正反应
热效应及方程式中A、B、C的化学计量数的
判断中,正确的是
A.吸热反应,m+n<p B.吸热反应,m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
![]() 16.在一定条件下,充入X和Y使可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为
16.在一定条件下,充入X和Y使可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为
A.2:1 B.1:1 C.2:3 D.3︰2
17.反应2X(g)
2Z(g)ΔH<0(正反应放热),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n2)与反应时间(t)的关系如图所示。下列说明正确的是( )
A T1<T2,P1<P2 B T1<T2,P1>P2
C T1>T2,P1>P2 D T1>T2,P1<P2
18.如图所示,500℃时容器分隔为A、B两部分,A、B之间档板可以自由移动,B有可移动的活塞,A中充入2mol SO3和1mol N2,B中充入2mol SO2和1mol O2,在相同条件下发生可逆反应 2SO3 ![]() 2SO2 + O2。下列说法正确的是
2SO2 + O2。下列说法正确的是
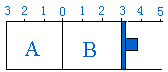 A.平衡后A、B两容器的体积比为2﹕1
A.平衡后A、B两容器的体积比为2﹕1
B.平衡后A、B两容器中SO2的体积分数相等
C.平衡后A、B两容器中SO3的转化率相等
D.平衡后两容器中SO2的物质的量A>B
第Ⅱ卷(共54分)
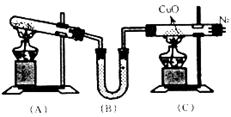 19.(14分)实验室用右图所示装置通过制取
19.(14分)实验室用右图所示装置通过制取
NH3再和CuO反应制得N2,同时还原CuO
得Cu。
(1)写出(C)中反应的化学方程式:
,
在此反应中NH3表现出 性。
(2)(B)中装有
药品,作用是
。
(3)停止反应时,应先撤离
装置中的酒精灯。
(4)从(C)装置出来的气体中可能含有
气体,若要获得较纯
的N2,应采用 方法收集。
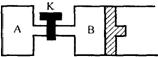 20.(6分)如图所示,当关闭K时,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)
20.(6分)如图所示,当关闭K时,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)![]() Z(g)+2W(g) (正反应是放热反应) ,达到平衡(Ⅰ)时,V(B)=0.8aL。请回答:
Z(g)+2W(g) (正反应是放热反应) ,达到平衡(Ⅰ)时,V(B)=0.8aL。请回答:
(1)B中X的转化率α(X)B为 ;
(2)A中W和B中W的物质的量分数比较:A B(填
大于、小于、等于);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 (用α的代数式表
示,连通管中气体体积不计)。
21.(8分)在一固定容积的密闭容器中,保持一定条件下进行以下反应:
X(气)+2Y(气)![]() 3Z(气). 已知加入1 molX和3molY。达到平衡后,生成a mol Z.
3Z(气). 已知加入1 molX和3molY。达到平衡后,生成a mol Z.
(1)在相同实验条件下,若在同一容器中改为加入2 mol X和6 mol Y,达到平衡后,Z的物质的量为 。
(2)在相同实验条件下,若在同一容器中改为加入2 mol X和8 mol Y,若要求在反应混合气体中Z体积分数不变,则还需加入Z mol。
(3)在相同实验条件下,若在同一容器中改为加入0.5molX,则需加入 mol Y,
加入 mol Z,才能使平衡时Z为0.9a mol。
22、(8分)在真空密闭容器中加入a mol PH4I固体,在一定温度下发生反应: PH4I(s)![]() PH3(g)+HI(g)
4PH3(g)
PH3(g)+HI(g)
4PH3(g)![]() P4(S)+6H2(g) 2HI(g)
P4(S)+6H2(g) 2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
以上三个反应建立平衡后,测得HI为bmol,I2(g)为cmol,H2为dmol。求:
(1)平衡后,容器内P4(g)和PH3(g)的物质的量(用a,b,c,d表示)
n(P4)==___________。
(2)a,b,c三者的关系服从a>___________(填b,c的代数式)。
(3)平衡后,增大压强容器内n(I2)________,n(PH4I)_________。(填增大、减小、不变)
23.(8分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2
混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入![]()
![]() 的NaOH溶液,恰好使溶液
的NaOH溶液,恰好使溶液
中的![]() 全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(表达式)
全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(表达式)
(3)欲使铜与硝酸反应生成的气体在![]() 溶液中全部转化为
溶液中全部转化为![]() ,至少需要30%
,至少需要30%
的双氧水 g。
24.(10分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,
发生如下反应: N2 (g) + 3 H2(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为
25%。 计算平移时NH3的物质的量 mol。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)
= 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,![]() (N2)∶
(N2)∶![]() (H2)= 。
(H2)= 。
高二化学试题答题卡
| 注意事项 | 1. 答题前,考生将自己的姓名、学号填写清楚。 2. 在草稿纸、试题卷上答题无效。 3. 请在规定的矩形区域内答题,超出该区域的答案无效! |
| 选择题 |
| ||||||||||||||||||||||||||||||||||||||||||
| 二.(本题包括6小题,共54分) 19.(1) 。 (2) , (3) 。 (4) , 20.⑴____ _______;⑵ ;⑶ 。 21.⑴ 、(2) ;(3) 、 22.(1) 。 (2) ;(3) 、 。 23.(1) 、 ;(2) ;(3) 24.(1) (2) (3) (4) (5) 。 请在规定的矩形区域内答题,超出该区域的答案无效! | |||||||||||||||||||||||||||||||||||||||||||
高二化学(参考答案)
一、选择题(54分,每题3分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | C | D | D | C | D | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | B | A | B | D | B | C | D |
二、主观题(54分,每空2分)
19、(1) 3CuO+2NH3![]() N2+3Cu+3H2O
还原
N2+3Cu+3H2O
还原
(2)碱石灰,干燥氨气 (3)C (4)N2、 NH3 、H2O,排水法
20、(1)80% (2)< (3)0.2a
21、(1) 2a (2)6 (3)1.9 1.2
22、(1) n(P4)==(1/6)(d—c)mol
(2) a>b+2c
(3) 减少 增加
23、(1)5.824 5.376
(2)![]()
(3)57.8
24、⑴a = 16
⑵ 8mol
⑶5∶4 ⑷2∶3 ⑸1∶2