高二级化学科寒假作业题一
一、选择题(每小题只有一个选项符合题意)
1、导致下列现象的主要原因与排放SO2有关的是:
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
2、硼有两种天然同位素510B、511B,硼元素的相对原子质量为10.8,则硼元素510B的原子个数百分比为:
A.21.5% B.80% C.18.5% D.20%
3、X、Y、Z都是气体,下列反应在减压或升温后,Z的含量都会提高的是:
A.X+2Y![]() 4Z(正反应是吸热反应) B.3X+Y
4Z(正反应是吸热反应) B.3X+Y![]() 4Z(正反应是吸热反应)
4Z(正反应是吸热反应)
C.2X+Y![]() Z(正反应是吸热反应) D.X+Y
Z(正反应是吸热反应) D.X+Y![]() 3Z(正反应是放热反应)
3Z(正反应是放热反应)
4、若使用浓H2SO4时不慎有少量浓H2SO4沾在皮肤上,清洗的方法是:
A.先用NaOH中和,再用水洗 B.用纱布擦净后涂油
C.用大量水冲洗 D.用布擦净后,用Na2CO3溶液冲洗
5、下列块状金属在常温时能全部溶于足量浓HNO3的是:
A.Pt B.Cu C.Al D.Fe
6、地壳中含量第一和第二的两元素形成的化合物,不具有的性质是:
A.可与纯碱高温下反应
B.与碳在高温下反应可制取两元素中的一种单质
C.是一种酸性氧化物,能与水反应生成对应的酸
D.属于无机非金属材料
7、在无色透明的强酸性溶液中,能大量共存的离子组是:
A.NH4+、 Na+ Cl- SO42- B.Cu2+ Mg2+ NO3- Cl-
C.Al3+ Ag+ NO3- Cl- D.Ba2+ K+ CO32- Cl-
8、关于非金属元素N、O、C、P的叙述,正确的是:
A.在通常情况下其单质均为气体 B.其单质均由双原子分子构成
C.都属于主族元素 D.每种元素仅生成一种氢化物
9、常温常压下,a、b、c、d四支体积相同的试管中,分别充有等体积混合的两种气体,它
们是:a、NO与NO2;b、Cl2和SO2;c、NO2与O2;d、NH3与N2。现将四支试管倒置于水槽中,充分反应后,最终各试管中水面上升高度顺序应为:
A.b>c>a>d B.b>a>c>d C.d>b>a>c D.b>c>d>a
|
A.H2O B.BF3 C.CCl4 D.PCl5
11、下列各组顺序的排列不正确的是:
A.离子半径:F->Na+>Mg2+>Al3+
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性:H3AlO3<H2SiO3<H2CO3<H3PO4
D.熔、沸点:NaCl>Na>CO2>SO2
12、在某化学反应中,某一反应物浓度是1.0mol/L,经过10s后,它的浓度变成了0.6mol/L,在这10s内,用该反应物表示的平均反应速率为:
A.0.04mol/(L·s) B.0.08mol/(L·s)
C.0.8mol/(L·s) D.0.08mol/L
13、某酸式盐NaHY的水溶液显碱性,下列叙述正确的是:
A.![]() 的电离方程式:
的电离方程式:![]()
![]()
![]()
B.![]() 离子的水解方程式:
离子的水解方程式:![]()
![]()
![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
14、下列离子方程式正确的是:
A.亚硫酸钠与稀硝酸反应:SO32-+H+ = H2O+SO2↑
B.向水玻璃中通入过量CO2:SiO32-+2CO2+2H2O = H2SiO3↓+2HCO3-
C.铜片加入稀硝酸中:Cu+NO3-+4H+ = Cu2++NO↑+2H2O
D.Al2O3与氢氧化钠溶液反应:Al2O3+OH-= AlO2-+H2O
15、下列的实验操作中所用仪器合理的是:
A.用25mL的碱式滴定管量取14.80mL NaOH溶液
B.用100mL量筒量取5.2mL盐酸
C.用托盘天平称取25.20g氯化钠
|
16、下列各反应的化学方程式中,属于水解反应的是:
A.H2O+H2O![]() H3O+ +OH- B.HCO
H3O+ +OH- B.HCO![]() +OH-
+OH-![]() H2O+CO
H2O+CO![]()
C.CO2+H2O
![]() H2CO3 D.CO
H2CO3 D.CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
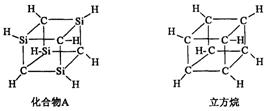 17、已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如右图:则C4Si4H8的二氯代物的同分异构体数目为:
17、已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如右图:则C4Si4H8的二氯代物的同分异构体数目为:
A.3 B.4
C.5 D.6
18、下列物质在一定条件下能跟某些金属单质,非金属单质、酸、碱均发生反应的是:
A.FeCl2 B.Fe2O3 C.HF D.NaHCO3
19、有一碱性溶液250mL,它可能是NaOH、Na2CO3、NaHCO3中的一种或两种。若加入足
量的稀盐酸,产生的挥发性气体用足量的Ba(OH)2溶液吸收,可得14.775g的白色沉淀物。另取相同体积的该碱性溶液,恰能使浓度为0.625mol/L的NaOH溶液100mL完全反应。该碱性溶液的可能组成是:
A.NaOH、Na2CO3
B.NaHCO3、Na2CO3
C.只含NaHCO3
D.只含Na2CO3
20、一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3
的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,
制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2。则下列说法中
正确的是:
A.通CO的一极是电池的正极
B.负极电极反应是:O2+2CO2+4e— = 2CO32—
C.熔融盐中CO32—的物质的量在工作时保持不变
D.正极发生氧化反应
二、填空题
21、有一包固体粉末可能含有Cu2+、Al3+、Mg2+、Cl- 、SO42-、CO32-中的若干种,现进行以下实验:①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出,②向①溶液中加入Ba(NO3)2溶液,无沉淀生成,再滴入AgNO3溶液,有白色沉淀生成 。③再取少量固体加入适量蒸馏水,搅拌后,固体全部溶解,得到无色透明溶液。④向③的溶液中加入氨水,使溶液呈碱性,有沉淀生成,过滤。向过滤所得沉淀中加入过量的氢氧化钠溶液,沉淀部分溶解。这包固体粉末中一定不含有的离子是______________,肯定含有的离子是__________________,这包固体粉末的组成物质是___________________。
22、实验装置如下图所示:
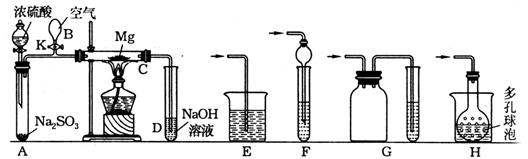
先关闭K,使A中反应进行一段时间后,再加热硬质玻璃管C,可观察到C管中发出耀眼的白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。请回答:
(1)C中全部产物有:_________________________________
(2)本实验先使A中反应进行,再加热C装置,其目的是:_____________________________
(3)停止实验时,先打开K,再停止滴加浓硫酸,熄灭酒精灯,橡胶气胆B在实验中的作用是:_____________________________________________________
(4)C中的Mg应放在不锈钢垫片上而不能直接接触玻璃管壁的原因是:______________
(5)若无装置B,K使用普通导管,本实验的尾气吸收装置可以选用图中________ 装置(填写序号)
23、工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拦,使之溶解,得一强酸性的混合溶液,现欲从该该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。]请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去? ,理由是 ,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:请回答以下问题
①加入NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,理由是 现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有 (有几个选几个填代号)
A.浓HN3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH的调整到3.7,可选用的有 (多选不限,填代号)
A. NaOH B.氨气 C.Cu(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
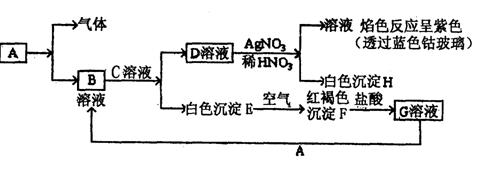
24、已知有以下物质相互转化
|
试回答:(1)写出B的化学式 D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。
25、Cu跟2.00L 1.00mol/L的硝酸反应,如果溶液中的NO3–的物质的量浓度下降了
0.1mol/L,试计算:(假设溶液的体积不变)
(1)反应产生的气体在标准状况下的体积是多少?
(2)反应后溶液中H+的浓度是多少?
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | A | C | B | C | A | C | D | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | C | B | A | D | B | A | B | C |
21.Cu2+、SO42-、CO32-; Al3+、Mg2+、Cl- ;MgCl2 AlCl3
22、(1)MgO、MgS、S(2)排尽反应体系内的空气
(3)防止D中的溶液发生倒吸(4)Mg要与玻璃中的SiO2反应
(5)、F、G\H
23、(1)不能,因Fe2+沉淀的pH最大,F2+沉淀完全时,Cu2+也沉淀。①A②不妥当,引入了新杂质Na+ ③C、D、E(2)C、E、F
24、(8分)(1)FeCl2 KCl(每空1分)
(2)4Fe(OH)2+O2+2H2O 4Fe(OH)3
(3)Fe3++3SCN— Fe(SCN)3 2Fe3++2Fe 3Fe2+(每空2分)
25、(1)4.48L (2)0.6mol/L