高二级化学科寒假作业题二
一、选择题(每小题只有一个选项符合题意)
1、下列物质属于强电解质的是 :
①BaSO4 ②CH3COOH ③H2SO4 ④SO3 ⑤Cl2 ⑥NaHCO3
⑦Cu ⑧盐酸 ⑨Ca(OH)2
A.①③⑥⑨ B.①③⑧⑨ C.③④⑥⑧⑨ D.③⑦⑧⑨
2、对于处于化学平衡状态的反应CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0,若要提高CO的转化率,下列措施中可行的是:
CO2(g)+H2(g)△H<0,若要提高CO的转化率,下列措施中可行的是:
A.升温 B.增大H2O(g)的浓度 C.增大压强 D.使用合适催化剂
3、下列叙述中所描述一定是金属元素的是:
A.易失去电子的物质
B.原子最外电子层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外电子层只有2个电子的元素
4、可以判定某酸HA是弱电解质的事实是:
A.其盐溶液呈酸性 B.该酸可溶解Cu(OH)2
C.该酸可以 CaCO3反应放出CO2 D.室温时0.01mol·L-1HA溶液pH=4
5、下列措施一定能使反应速率加快的是:
①增加反应物的物质的量 ②升高温度
③缩小反应容器体积 ④加入生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
6、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程上来,
其主要的原因是:
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解腐蚀其他物品
D.回收其中石墨电极
7、下列离子方程式正确的是:
|
B.用惰性电极电解饱和NaC1溶液:2C1-+H2O C12↑+H2↑+2OH-
C.FeBr2溶液中通入足量C12:2Fe2++2Br-+2C12=2Fe3++Br2+4C1-
D.向CaC12溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
8、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,负极电极反应式为:C2H6+18OH-→2CO32-+12H2O+14e-,下列叙述中不正确的是:
A.正极发生反应是:O2+2H2O+4e-→4OH-
B.参加反应的C2H6与O2的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中阳离子向正极移动
9、用惰性电极电解饱和Na2SO4溶液,若保持温度不变,则一段时间后:
A.溶液pH变大
B.c(Na+)与c(SO42-)的比值变大
C.溶液浓度变大,有晶体析出
D.溶液浓度不变,有晶体析出
|
A.10mL0.5mol·L-1CH3COONa溶液与6mL 1mol·L-1盐酸混合;
c(C1-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol·L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4C1溶液;
c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4C1)
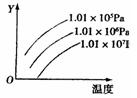 11、下图表示温度、压强对平衡N2(g)+3H2(g)
11、下图表示温度、压强对平衡N2(g)+3H2(g)![]() 2NH3(g)△H<0的影响,Y轴是指:
2NH3(g)△H<0的影响,Y轴是指:
A.平衡气体中NH3的体积分数
B.H2的转化率
C.N2的物质的量
D.正反应速率
12、用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠溶液恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是:
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
13、下列各组离子,在溶液中一定能大量共存的是:
A.pH=1的溶液中:NO3-、I-、Fe2+、K+
B.pH=7的溶液中:Fe3+、Mg2+、C1-、SO42-
C.pH=14的溶液中:S2-、SO32-、Na+、K+
D.由水电离出c(H+)=10-14mol·L-1溶液中:Na+、K+、SO42-、CO32-
14、已知建立化学平衡的可逆反应:X(g)+Y(g)![]() 3Z(g),改变条件,使化学平衡向正反应方向移动,下列叙述正确的是:
3Z(g),改变条件,使化学平衡向正反应方向移动,下列叙述正确的是:
A.生成物的质量分数一定增大
B.生成物的浓度一定增大
C.反应物的转化率都增大
D.生成物的质量一定增大
15、下列有关反应的化学方程式正确的是:
A.Na2S溶液显碱性的原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
|
C.铝热反应:2Fe+Al2O3 2Al+Fe2O3
D.Fe与稀硝酸反应的离子方程式是:Fe+2H+=Fe2++H2↑
16、下列说法不正确的是:
A.pH=3的醋酸与pH=11的NaOH溶液等体积混合后,溶液的pH一定小于7
B.pH<7的溶液一定是酸溶液
C.pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍
D.在1mol·L-1的氨水中,改变外界条件使c(NH4+)增大,溶液的pH不一定增大
17、Fe3+和I-在水溶液中的反应如下:2I--+2Fe3+![]() 2Fe2++I2(水溶液)。正向反应速率和I-、Fe3+的浓度关系为v=k[I-]m[Fe3+]n(k为常数)
2Fe2++I2(水溶液)。正向反应速率和I-、Fe3+的浓度关系为v=k[I-]m[Fe3+]n(k为常数)
| [I-](mol·L-1) | [Fe3+](mol·L-1) | v(mol·L-1·s-1) | |
| (1) | 0.20 | 0.80 | 0.032k |
| (2) | 0.60 | 0.40 | 0.144k |
| (3) | 0.80 | 0.20 | 0.128k |
在v=k[I-]m[Fe3+]n中,m、n的值为:
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
18、如图所示,在锌、铜和稀硫酸组成的原电池中,正极发生的反应是:
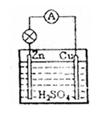 A.Cu2++2e—=Cu
A.Cu2++2e—=Cu
B.2H++2e—=H2↑
C.Cu-2e=Cu2+
D.Zn-2e—=Zn2+
19、下列有机物命名正确的是:
A.2,3—二甲基丁烷
B.2—甲基—4—乙基戊烷
C.2—乙基丙烷
D.1,3,5—三甲基己烷
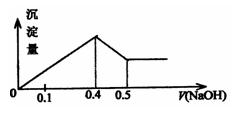 20、现有AICI3和MgSO4混合溶液,和其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中以CI-与SO42-的物质的量之比为 :
20、现有AICI3和MgSO4混合溶液,和其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中以CI-与SO42-的物质的量之比为 :
A.1:3
B.2:3
C.6:1
D.3:1
二、填空题
21、在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所
观察到的现象是 ,
其原因是(只写相关的离子方程式): 。
22、有A、B、C、D四种无色溶液,它们分别是![]() 溶液、
溶液、![]() 溶液、盐酸和
溶液、盐酸和![]() 溶液中的一种。
溶液中的一种。
(1)已知A、B的溶液中水的电离程度相同,A、C溶液的pH相同。A是____________溶液,B是______________溶液,C是_______________溶液。
(2)若B溶液中![]() 与C溶液中的
与C溶液中的![]() 相同,现将B的溶液稀释10倍后溶液的pH值用
相同,现将B的溶液稀释10倍后溶液的pH值用![]() 表示,C溶液的pH值用
表示,C溶液的pH值用![]() 表示,则
表示,则![]() __________________(填大于或等于某个数)。
__________________(填大于或等于某个数)。
23、有一种pH为12的NaOH溶液100 mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加____________mL;(溶液总体积允许相加。下同)
(2)如果加入pH=10的NaOH溶液,应加______________mL;
(3)如果加入![]() 的盐酸,应加__________________mL。
的盐酸,应加__________________mL。
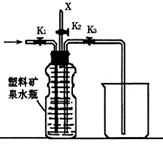
24、下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请回答下列问题:
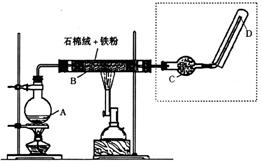
(1)实验前必须对整套装置进行气密性检查,操作方法是
(2)B中发生反应的化学方程式为 。
(3)反应前A中投放碎瓷片的目的是 。
(4)酒精灯和酒精喷灯点燃的顺序是 ,为什么
(5)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因 。
(6)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气体即可检验H2的存在。实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间之后,必须进行 _______操作,方可关闭K2、打开K3,再收集气体。当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法是 。
(7)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是 。
25、已知多元弱酸在水溶液中的电离是分步进行的,且第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度……今有HA、H2B、H3C三种一元、二元、三元弱酸,根据“较强酸+较弱酸盐 较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:
①![]()
②![]()
③![]()
回答下列问题:
(1)相同条件下,HA、![]() 、
、![]() 三种酸中酸性最强的是___________.
三种酸中酸性最强的是___________.
(2)![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、HC2- 6种离子中,最易结合质子的是___,
、HC2- 6种离子中,最易结合质子的是___,
最难结合质子的是________.
(3)判断下列反应的离子方程式中正确的是(填写标号)______________.
A.![]() B.
B.![]()
C.![]()
(4)完成下列反应的离子方程式.
A.![]() (过量)__________________________;
(过量)__________________________;
B.HA(过量)![]() __________________________.
__________________________.
26、合成氨厂常通过测定反应前后气体的平均式量来测定N2的转化率,某工厂测得进入合成塔的N2.H2混合气体的平均式量为12.4,在相同状况下从合成塔出来的混合气体的平均式量为15.5,求N2 的转化率。
寒假作业二(参考答案)
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | B | D | D | C | B | A | B | D | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | A | C | D | C | B | C | B | A | C |
21、CO32-
+ H2O![]() HCO3-
+ OH- ;CO32-
+ Ba2+ = BaCO3↓
HCO3-
+ OH- ;CO32-
+ Ba2+ = BaCO3↓
22、(1)![]() ;
;![]() ;盐酸 (2)
;盐酸 (2)![]()
23、(1)900 (2)1000 (3)81.8
24、(1)将玻璃管口D没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好。(2分)
(2)![]()
(3)防止暴沸
(4)先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;(1分)防止先点燃酒精喷灯所导致的Fe与O2的反应。(1分)
(5)过量的铁与生成的Fe3+反应生成Fe2+,故加入KSCN溶液后颜色无明显变化
(6)验纯 关闭K3、打开K2在X处点燃氢气,挤压矿泉水瓶
(7)氢气是否干燥并不影响该实验
25、(1)![]() (2)
(2) ![]() ,
,![]() (3)BC(4)
(3)BC(4)![]()
![]()
26、 25%