高二级化学科寒假作业题三
一、选择题(每小题只有一个选项符合题意)
1、主链含5个碳原子,有甲基、乙基2个支链的烷烃有:
A.2种 B.3种 C.4种 D.5种
2、某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断:
A.R气态氢化物化学式为H2R B.R一定是IVA族元素
C.R的气态氢化物比周期其他元素气态氢化物稳定
D.R一定是第四周期元素
3、下列关系式正确的是:
A.CH3COONa溶液中:c(H+)>c(OH-) B.Na2S溶液中:c(Na+):c(S2-)=2:1
C.NH4Cl溶液中:c(H+)=c(OH-) D.(NH4)2SO4溶液中:c(NH4+):c(SO42-)<2:1
4.能证明醋酸是弱酸的事实是:
A.醋酸能使紫色石蕊试液变红
B.醋酸能被弱碱氨水中和
C.醋酸溶液的pH小于7
D.常温下,0.1mol·L—1醋酸溶液中的c(H+)为1.32×10—3mol·L—1
5、在一个2L的密闭容器中,某反应物的物质的量为1.0mol,经过20s后,它的物质的量变成了0.6mol,在这20s内它的反应速率为:
A.0.4mol/L B.0.01mol/(L·s) C.0.01mol/L D.0.02mol/(L·s)
6、能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液一一区分开的是:
A.Ba(OH)2 B.KNO3 C.NaOH D.BaCl2
7、在NaOH溶液中能大量共存的离子组是:
A.K、HCO![]() 、Cl—、SO
、Cl—、SO![]() B.S2—、CO
B.S2—、CO![]() 、C—、K—
、C—、K—
C.K+、NH![]() 、SO
、SO![]() 、Na+ D.Na+、Mg2+、NO
、Na+ D.Na+、Mg2+、NO![]() 、SO
、SO![]()
8、在中和滴定中,下列操作或说法不正确的是:
A.使用滴定管时,滴定管必须用待装液润洗2—3次
B.酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液
C.盛装准确量取的待测液的锥形瓶应预先用待测液润洗
D.滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进
行调整
|
A.1:1:1 B.3:2:1 C.3:2:3 D.1:1:3
10、下列事实,不能用勒沙特列原理解释的是:
A.溴水中有下列平衡Br2 + H2O![]() HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO;△H<0,升高温度可使平衡向逆反应方向移动
CO2+NO;△H<0,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
11、取ag某物质在氧气中完全燃烧,将其燃烧产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag,下列物质中不能满足上述结果的是:
A.H2 B.CO C.C6H12O6 D.C12H22O11
12、根据下列反应,不能制备得到Al(OH)3的是:
A.Al2O3+3H2O=2Al(OH)3↓
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3↓
C.2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
D.2KAl(SO4)2+6NaOH=2Al(OH)3↓+K2SO4+3Na2SO4
13、下列除去杂质的方法正确的是:
A.除去N2中的少量O2,通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl;通入Na2CO3溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3;加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量MgCl2;加入适量NaOH溶液,过滤
14、按下列实验方法操作,能达到要求的是:
A.用托盘天平称量25.20g氯化钠固体
B.将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
C.用紫色石蕊试液鉴别SO2和CO2两种气体
D.用二硫化碳洗涤沾有硫黄的试管
15、下列金属中,一定条件下既能跟Cl2反应,又能跟稀盐酸反应,且均生成MCl2型化合物的是:
A.Al B.Fe C.Cu D.Mg
16、下列离子组在酸性条件下能大量共存的是:
A.S2-、SO42-、Na+、SO32- B.MnO4-、HCO3-、NO3-、K+
C.S2O32-、Fe3+、SCN-、K+ D.K+、NO3-、SO42-、Na+
17、下列化学反应中,硝酸只表现氧化性的是:
A.3Cu + 8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+ 4H2O
B.CuO + 2HNO3(稀) =Cu(NO3)2 + H2O
C.C + 4HNO3(浓)=CO2↑+ 4NO2↑+ 2H2O
D.3Ag + 4HNO3(稀) =3AgNO3 + NO↑+ 2H2O
18、钡和钠相似,也能形成含O22-的过氧化物,下列叙述中正确的是:
|
B.O22的电子式为:
C.反应Na2O2 + 2HCl =2NaCI + H2O2为氧化还原反应
D.过氧化钡和过氧化钠都具有强氧化性
19、对可逆反应:N2+3H2![]() 2NH3(正反应为放热反应)来说,下列叙述中正确的是:
2NH3(正反应为放热反应)来说,下列叙述中正确的是:
A.达到化学平衡状态时,反应物和生成物的浓度相等
B.在其它条件不变时,使用催化剂不能改变化学平衡状态
C.在其它条件不变时,升高温度可使化学平衡向生成氨的方向移动
D.在其它条件不变时,增大压强,化学平衡将向逆反应方向移动
20.锌与稀硫酸反应制取氢气,由于反应速度太快无法控制,常加入某些物质减缓反应速率而不影响生成氢气的总量,可加入的物质有:
A.少量CH3COONa固体 B.少量Na2CO3固体
C.少量CuSO4固体 D.少量NaOH固体
二、填空题
21、在热的稀硫酸中溶解11.4gFeSO4后再加入50mL0.5mol/LKNO3,Fe2+恰好全部生成Fe3+,KNO3也反应完全,并有NXOY气体逸出。
(1)推算出X= ,Y=
(2)先在方框中填入NXOY的化学式,再配平。
FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+ + H2O
(3)反应中还原剂为 ,氧化剂与氧化产物的物质的量之比为 。
22、(1)室温时,将0.1mol氨气溶于水制成1L溶液,则该溶液的pH为 [假设室温时,Kb(NH3·H2O)=1.0×10-5mol·L-1]若在上述溶液中加入稀硫酸,使其恰好完全中和,所得溶液中离子浓度由大到小的顺序为 ;若向所得溶液中加入少量硫酸铵固体,水解程度 (填“增大”、“减小”或“不变”)。
(2)T=593K,P=2×107Pa的体积百分比为60%的CO及40%的H2是混合物,让其通过活性
 氧化锌催化剂后,将有一部分转化为甲醇,反应为: CO(g)+2H2(g)
氧化锌催化剂后,将有一部分转化为甲醇,反应为: CO(g)+2H2(g)![]() CH3OH(g)。已知CO的转化率为16%,则H2的转化率是
,若容器的温度容积不变,此时气体的压强是
Pa。
CH3OH(g)。已知CO的转化率为16%,则H2的转化率是
,若容器的温度容积不变,此时气体的压强是
Pa。
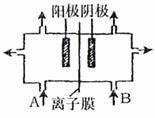
23、工业上电解饱和食盐水中,常将两个极室用离子膜隔开(如图),
其目的是 ,阳极室(A处)加入
,阴极室(B处)加入
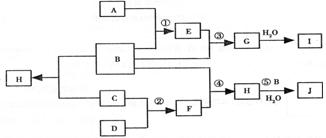
24、(10分)下图是部分短周期元素的单质及其人合物的转化关系
图(有关反应的条件及生成的H2O已略去),已知:
A.A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
B.反应①②是化工生产中的重要反应。
C.化合物E具有漂白性,且是大气污染物。
D.I、J都能跟F反应,且生成物均为常用氮肥。
|
请按要求填空:
(1)写出反应③和④的化学方程式 、 。
(2)C的结构式 ;H的化学式 。
(3)化合物E与溴水反应的离子方程式
25、实验室现有如下试剂,浓硫酸、浓盐酸、浓硝酸、浓氨水、30%H2O2、MnO2、碱石灰、
亚硫酸钠、铜屑
判断能否用上述试剂制取下表中的干燥气体并填写相应空格
| 气体 | 判断 | 制备原理 | 可用干燥剂 |
| O2 | 能 | ||
| NH3 | |||
| HCl | |||
| NO2 | |||
| Cl2 | |||
| SO2 |
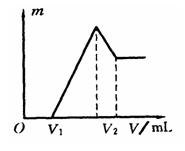 26、将镁、铝的混化物0.1mol溶于100mL 2mol·L-1H2SO4溶
26、将镁、铝的混化物0.1mol溶于100mL 2mol·L-1H2SO4溶
液中,然后再滴加1mol·L-1NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化关系如图所示,当V1 = 160mL时,则金属粉末中n(Mg) = mol,V2 = mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、AI3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) = mL。
(3)若混合物仍为0.1mol,其中Mg粉的物质的量的分数为a,用100mL2 mol·L-1的硫酸溶解此混合物后,再加入450mL1mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,满足此条件a的取值范围是 。
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | A | D | D | B | A | B | C | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | C | D | D | D | C | D | B | A |
21.(1)x=1;y=1
(2)6FeSO4+2KNO3+4H2SO4=1K2SO4+3Fe2(SO4)2+2NO+4H2O
(3)FeSO4;2:3
22.
(1)11,[NH4+]>[SO42-]>[H+]>[OH-],减小
(2)48%, 1.616×107
23、防止H2与C12混合爆炸,防止C12与NaOH反应使NaOH不纯;
精制饱和食盐水;去离子水
24、2SO2+O2
![]() 2SO3 4NH3+5O2
2SO3 4NH3+5O2
![]() 4NO+6H2O
4NO+6H2O
(2)N≡N;NO
(3)Br2+2H2O+SO2====2Br-+SO42-+4H+
25、略
26.(1)0.06 440 (2)400 (3)0.5≤a<1