高二级化学科第一学期周末考试题卷
本试卷分选择题和非选择题两部分,满分150分。考试时间120分钟。
注意事项:
1、答卷前,考生务必用黑笔字迹的钢笔或签字笔将自己的班级、姓名和考生号填写在答题卡密封线内。
2、选择题每小题选出答案后,用2B型铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再涂选其他答案;不能答在试题卷上。
3、非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4、考生必须保持答题卡整洁,考试结束后,缴交答题卷。
可能用到的原子量:O:16 H:1 Na:23 Fe:56 N:14 S:32 Cl:35.5
Cu:64 F:19
第一部分 选择题(共78分)
一、选择题(本题包括10小题,每题只有一个正确选项,每题3分,共30分)
1、下列叙述正确的是 ( )
A.石油裂解可以得到氯乙烯
B.油脂水解可以得到氨基酸和甘油
C.所有烷烃和蛋白质中都存在碳碳单键
D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖
2、具有解热镇痛及抗生素作用药物“芬必得”主要成分结构简式如下,属于( )
![]()
①芳香族化合物、②有机羧酸、③苯甲酸的同系物、④有机高分子⑤芳香烃
A.② ③ ⑤ B.② ③ ④ C.① ② ③ D.① ② ③ ④
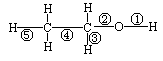 3、乙醇分子中不同的化学键如右图。下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
3、乙醇分子中不同的化学键如右图。下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
A.与金属钠反应时,键①断裂
B.在Ag催化下与O2反应时,键①、③断裂
C.与CuO反应时,键①断裂
D.与浓硫酸共热至140℃时,键①或键②断裂;共热至170℃时,键②、⑤断裂
4、下列有机物的命名中正确的是( )
A.2,2-二甲基-1-丁炔 B.2,4,4-三甲基戊烷
C.1,2-二甲基-1-丙醇 D.2-甲基-1,3-丁二烯
5、涂改液是一种使用率较高的产品,但实验证明涂改液含有苯的同系物与卤代烃。下列说法不正确的是( )
A.涂改液危害人体的健康,污染环境
B.中学生最好不用或慎用涂改液
C.苯的同系物与卤代烃没有刺鼻性气味
D.苯的同系物与卤代烃是涂改液中的溶剂
6、在同温同压下,下列各组热化学方程式中Q2 > Q1的是
A、2H2(g)+O2(g)=2H2O(l) ΔH== - Q1 2H2(g)+O2(g)=2H2O(g) ΔH== - Q2
B、S(g)+O2(g)=SO2(g) ΔH== - Q1 S(s)+O2(g)=SO2(g) ΔH== - Q2
C、C(s)+1/2O2(g)=CO(g) ΔH== - Q1 C(s)+O2(g)=CO2(g) ΔH== - Q2
D、H2(g)+Cl2(g)=2HCl(g) ΔH== - Q1 1/2H2(g)+1/2Cl2(g)= HCl(g) ΔH== - Q2
7.下列关于反应热的说法正确的是
A、 当∆H为“-”时,表示该反应为吸热反应
B、已知C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热 为110.5kJ
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热 为110.5kJ
C、反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D、化学反应的反应热只与反应的始态和终态有关,而与反应的途径无关
8、下列过程一定释放出能量的是
A.化合反应 B.分解反应 C.分子拆成原子 D.原子组成分子
9、在一定温度下,不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是:
2C(g)达到平衡的标志的是:
(1)C的生成速率是B的生成速率的2/3倍;(2)单位时间生成amolA,同时生成3amolB;(3)A、B、C、的浓度不再变化;(4)混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amolA,同时生成3amolB;(7)A、B、C、的分子数目比为1:3:2。
A. (2)(7) B.(6)(4) C.(1)(3) D.(5)(6)
10、一定条件下反应N2(g)+3H2(g)
![]() 2NH3(g
)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
2NH3(g
)在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
二、选择题(本题包括12小题,每小题4分,共48分;每小题仅有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个的都正确的给4分,但只要选错一个,该小题就为0分。)
11、化学反应2A+B
![]() 2C,达到化学平衡时,如果已知B是气体,增大压强时,平衡向逆反应方向移动,则( )
2C,达到化学平衡时,如果已知B是气体,增大压强时,平衡向逆反应方向移动,则( )
A. A 是气体,C是固体 B. A、B 、C 都是气体
C. A、C都是固体 D . A 是固体,C是气体
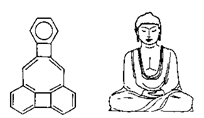 12、美国康乃尔大学的魏考克斯(C.
Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
12、美国康乃尔大学的魏考克斯(C.
Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(所有原子在同一平面),有关该有机分子的说法正确的是( )
A.该有机物属于芳香烃
B.该有机物属于苯的同系物
C.该有机物分子中含有22个碳原子
D.该有机物一氯代物只有2种
13、由-CH3、-OH、-C6H5、-COOH四种基团两两组合而成的有机化合物中,其水溶液能使紫色石蕊试液变红的有( )种。
A.1 B.2 C.3 D.4
14、冬季所用护肤品有效成分为保湿因子,其主要作用是使皮肤上附着一层吸水和保水的物质,感觉舒适而不干燥,下列物质中可能被采用的是( )
A.乙醇 B.丙三醇 C.甲醇 D.聚氯乙烯
15、下列哪个说法可以证明反应N2+3H2![]() 2NH3已达到平衡状态( )。
2NH3已达到平衡状态( )。
A. 1个N≡N键形成的同时,有3个H-H键形成
B. 1个N≡N键断裂的同时,有3个H-H键断裂
C. 1个N≡N键断裂的同时,有6个N-H键断裂
D. 1个N≡N键断裂的同时,有6个H-H键形成
16、下糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A. 牛油、纤维素和蛋白质都是天然高分子化合物
B. 淀粉水解的最终产物是葡萄糖
C. 葡萄糖能发生氧化反应和水解反应
D. 浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质的颜色反应
17、化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:
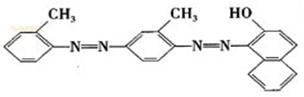
下列关于“苏丹红4号”说法正确的是
A.不能发生加成反应 B.属于芳香化合物
C.可以使酸性高锰酸钾溶液褪色 D.属于甲苯同系物
18.下列各组物质的燃烧热相等的是
A、碳和二氧化碳 B、1mol碳和3mol碳
C、3mol乙炔(C2H2)和1mol苯 D、淀粉和纤维素
19.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
![]() A. 2NO2 N2O4
(正反应为放热反应)
A. 2NO2 N2O4
(正反应为放热反应)
![]() B. C(s)+ CO2 2CO (正反应为吸热反应)
B. C(s)+ CO2 2CO (正反应为吸热反应)
![]() C. N2 + 3H2 2NH3 (正反应为放热反应)
C. N2 + 3H2 2NH3 (正反应为放热反应)
![]() D. H2S H2
+ S(s)(正反应为吸热反应
D. H2S H2
+ S(s)(正反应为吸热反应
![]() 20、可逆反应:A+3B 2C+2D在不同条件下的反应速率如下,其中反应速率最快的是( )
20、可逆反应:A+3B 2C+2D在不同条件下的反应速率如下,其中反应速率最快的是( )
A.v(A)=0.15mol/(L·s) B.v(D)=0.45mol/(L·s)
C.v(c)=0.4mol/(L·s) D.v(B)=0.6mol/(L·s)
21、在一密闭容器中,反应a A(气)![]() b B(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B浓度是原平衡时的60%,则( )
b B(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B浓度是原平衡时的60%,则( )
A. 平衡向逆反应方向移动了 B. 物质A的转化率减少了
C. B的质量分数增加了 D. a > b
22、对于可逆反应 2AB3(g) ![]() A2(g) + 3B2(g) (正反应吸热)下列图像正确的是
A2(g) + 3B2(g) (正反应吸热)下列图像正确的是
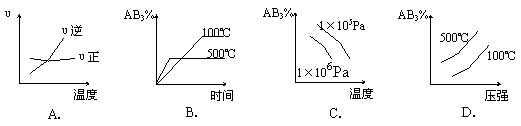 |
第二部分 非选择题(共72分)
三、填空题(每空2分 共40分)
23、下列各组物质 ① O2和O3 ② H2、D2、T2 ③ 12C和14C ④ CH3CH2CH2CH3 和 (CH3)2CHCH3⑤乙烷和丁烷⑥CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5
互为同系物的是__________, 互为同分异构体的是_____________
互为同位素的是______, 互为同素异形体的是__________,
是同一物质的是_______。
24、下列有关实验的叙述,正确的是(填序号)
A、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用浓氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
F、用酒精洗涤盛放过苯酚的试管;
G、用热NaOH溶液洗涤有油脂的试管
25、2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水和2.24LCO2(标准状况)并放出68.35kJ热量,则该反应的热化学方程式是
26、对于A+2B(气) ![]() nC(气) 在一定条件下达到平衡后,改变下列条件,请回答:
nC(气) 在一定条件下达到平衡后,改变下列条件,请回答:
(1)增压,平衡不移动,当n=2时,
A的状态为 ;当n=3时,A的状态为 .
(2)若A为固态,增大压强,C的组分含量减少,则n .
(3)升温,平衡向右移动,则该反应的逆反应为 热反应.
27、①CaCO3(s) == CaO + CO2(g);ΔH= 177.7kJ/mol
②C(s) + H2O(g)== CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) == 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) == CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) == CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) == NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) == 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有___________
(2)根据上述信息,写出C转化为CO的热化学方程式______________________________。
(3)上述反应中,表示燃烧热的热化学方程式有_________;表示中和热的热化学方程式有______________。
28、(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g) △H=-1160 kJ·mol-1
标准状况下4.48L CH4还原NO2至N2整个过程中放出_______ kJ热量。
(2)依据事实,写出下列反应的热化学方程式。
A.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________
B.若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量_______________________________
C.用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。 ___________________________________
D.已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
四、实验题(共16分)
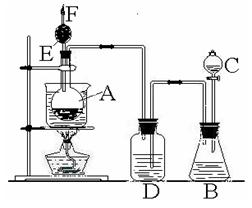 29、右图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
29、右图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器。当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生。此时水浴加热,发生化学反应。过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出。试回答:
(1) B逸出的主要气体名称__________;
(2) D的作用是___________________;
(3) E的作用是___________________;
(4) F管口点燃的气体分子式__________________
(5) A中无水硫酸铜粉末变蓝的原因是____________________________;
(6)A中发生的方程式
30、.在2L密闭容器中放入a mol A﹑b mol B,在一定条件下发生如下反应:
2A(g) + B(g) ![]() 3C(g)若经过t分钟反应达平衡状态,测得前t分钟C物质的生成速度为W mol/(L﹒min),则A物质的转化率为 ,B物质的平衡浓度为
.
3C(g)若经过t分钟反应达平衡状态,测得前t分钟C物质的生成速度为W mol/(L﹒min),则A物质的转化率为 ,B物质的平衡浓度为
.
五.综合题(16分)
31、ACV是一种由苹果发酵而成的酸性饮品,是具有明显药效的健康食品,有解毒、降脂、减肥和止泻功能。苹果酸是这种饮料的主要酸性物质,分离提纯后的化学分析如下:
①元素分析证明该酸只含C、H、O三种元素,其中C、H、O的质量比为24:3:40;该酸蒸气的密度是同温同压下氢气密度的67倍。
②0.1mol该酸与足量NaHCO3,反应放出4.48LCO2;等量的该酸与足量金属钠反应放出3.36L H2(气体体积均已折算为标准状况下的体积)。
请回答下列问题:
(1)该酸的分子式为 ;若已知该物质所有碳原子成直链状,则其结构简式为 。(2)写出该酸在加热和Cu / Ag催化条件下,被氧气氧化的反应化学方程式 。
32、在2L的密闭容器中将NO2加热到某温度时,进行如下的反应:2NO2![]() 2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
2NO+O2,反应5分钟后达平衡,测得平衡时各组分的浓度分别为:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。试求:
⑴NO2的转化率为________
⑵平衡时该温度下的K=__________
⑶在这5分钟内,用O2来表示的平均反应速率是___________