高中二年级化学学业水平测试试题
《化学1》模拟卷
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Zn 65
说明:本试卷分第一部分选择题和第二部分非选择题,共100分,考试时间75分钟。请将第Ⅰ卷的答案填涂在答题卡上,在第II卷上直接作答。考试结束后,请上交答题卡和第II卷。
第Ⅰ卷(共68分)
一、选择题(本题包括21小题,每小题只有一个选项符合题意,1~16题每小题3分,17~21题每小题4分,共68分。)
1.实验室中能用磨口玻璃瓶保存的是:( )
A、KOH B、溴水 C、水玻璃 D、氢氟酸
2.通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A、HCl B、Cl2 C、NH3 D、NO
3.下列物质中,不能使品红溶液褪色的是 ( )
A、Cl2 B、HCl C、SO2 D、活性炭
4.下列反应都有沉淀生成,其中属于氧化还原反应的是(B )
A. Na2SO4+BaCl2===2NaCl+BaSO4↓ B. 4Fe(OH)2+O2+2H2O== 4Fe(OH)3↓
C. FeCl3+3KOH===Fe(OH)3↓+3KCl D.CuCl2+2NaOH===Cu(OH)2↓+2NaCl
5.关于Na2CO3和NaHCO3性质的说法正确的是( B )
A.在水中的溶解性:NaHCO3>Na2CO3 B.热稳定性:NaHCO3<Na2CO3
C.与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3
D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
6.金属钠长期暴露在空气中,它的最终产物是 ( C )
A.Na2O2 B.NaOH C.Na2CO3 D.NaHCO3
7.下列各种仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦ B.②⑥⑦ C.①④⑧ D.④⑥⑧
8.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
9.溴化碘(IBr)的化学性质类似卤素单质,它与水反应的化学方程式为( )
IBr + H20= HBr + HIO 下列关于IBr有关性质的叙述中,正确的是
A.与水反应中既是氧化剂又是还原剂
B.与NaOH反应生成碘化钠和次溴酸钠
C.可作氧化剂 D.与水反应是氧化还原反应
10. 把铁片放入下列溶液中,铁片溶解,溶液质量增重且无气体放出的是( )
A CuSO4溶液 B FeCl3溶液 C 稀硫酸 D 盐酸
11.能用H+ + OH- = H2O 来表示的化学反应是( )
A、CuO溶于稀H2SO4 B、澄清石灰水和HNO3溶液反应
C、KOH溶液和碳酸溶液反应 D、Ba(OH)2 溶液和H2SO4溶液反应
12.下列物质中常温下既能与NaOH溶液反应,又能与盐酸反应产生氢气是( )
A、Mg B、Cl2 C、Si D、Al
13.在无色溶液中,下列离子能大量共存的是:( )
A、Mg2+、SO42-、K +、Cl- B、Na+ 、NH4+ 、NO3-、MnO4-
C、K + 、Cu2+ 、Cl-、Br- D、Ba2+ 、Na+ 、OH-、HCO3-
14.在一定条件下,将集满二氧化氮气体的试管倒立在盛水的水槽中,与水充分作用后,剩余气体的体积变成原气体体积的( )
A.1/2 B.2/3 C.1/3 D.3/8
15. 有NaCl、KSCN、NaOH、AgNO3四种溶液,只用一种试剂就把它们鉴别开来,这种试剂是( )
A.盐酸 B.Na2CO3溶液 C. 氯水 D.FeCl3溶液
16.8g无水硫酸铜配成0.1mol/L的水溶液,下列说法正确的是( )
A.溶于500mL水中 B.溶于1L水中
C.溶解后溶液的总体积为500ml D.溶解后溶液的总体积为1L
17.下列各溶液中,Na+物质的量浓度最大的是( )
A.4L0.5mol/LNaCl溶液 B.1L0.3mol/LNa2SO4溶液
C.5L0.4mol/LNaOH D.2L0.15mol/LNa3PO4
18.下列离子方程式正确的是(D )
A. 亚硫酸钠与盐酸反应:Na2SO3+2H+===2Na2++SO2↑+ H2O
B.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
C.稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑
D. 硫酸溶液与氢氧化钠溶液反应:H++ OH-==H2O
19. 实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是( )
A、NaOH溶液 B、Ba(OH)2溶液 C、盐酸 D、氨水
20.下列气体既不能用浓H2SO4干燥又不能用碱石灰干燥的是( )
A.Cl2 B.HI C.NH3 D.CO2
21.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率
4NO(g)+6H2O(g)在10 L密闭容器中进行,10s后,水蒸气的物质的量增加了0.60 mol,则此反应的平均速率![]() (X)(反应物的消耗速率或产物的生成速率)可表示为( )
(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.![]() (NH3)=0.0060 mol/(L·s)B.
(NH3)=0.0060 mol/(L·s)B.![]() (NO)=0.0040 mol/(L·s)
(NO)=0.0040 mol/(L·s)
C.![]() (O2)=0.0060 mol/(L·s) D.
(O2)=0.0060 mol/(L·s) D.![]() (H2O)=0.036 mol/(L.min)
(H2O)=0.036 mol/(L.min)
第Ⅱ卷(非选择题,共32分)
二、填空题
22.(8分)在标准状况下,1mol 任何气体体积为22.4L。那么在标准状况下,700L NH3 的物质的量为 mol,全部溶解在1L水中,所得溶液的质量分数为 , 如果该氨水的密度为0.85g·cm-3 ,则氨水的体积为 L ,物质的量浓度为 。
三、推断题
23. (5分)有X、Y、Z三种元素:
(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
(5)Z单质溶于X2Y中,所得溶液具有漂白性。
试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:
XZ_______,X2Y_________。
24.(7分)下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。试推断:
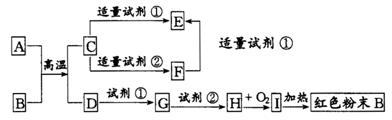
(1)写出物质的化学式:
A:________ C:________ Ⅰ:________
(2)写出下列反应的方程式:
C→F的离子方程式
H→I的化学方程式
四、实验题
25.(7分)红热木炭与浓H2SO4反应的化学方程式是
浓硫酸的作用是___________________。按下图装置进行实验,可证明碳和浓硫酸反应放出气体SO2和CO2气体。已知图中4个洗气瓶均装有检测液。现给出4种溶液①品红溶液②酸性高锰酸钾溶液③品红溶液④澄清石灰水。试指出各洗气瓶内所剩液体的作用。
①
②
③
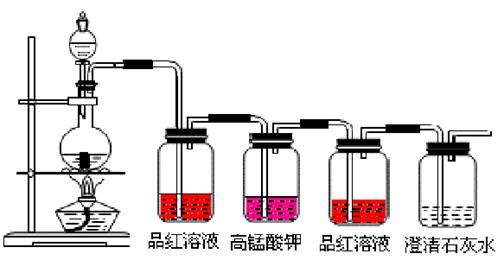 ④
④
五、计算题(本题包括1小题 共5分)
26.(5分)将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算所得溶液中硫酸锌的物质的量浓度和质量分数各是多少?
参考答案
一、选择题(本题包括21小题,每小题只有一个选项符合题意,1~16题每小题3分,17~21题每小题4分,共68分。)
1.B 解析:玻璃中含有二氧化硅,能与KOH溶液和氢氟酸反应,水玻璃是一种黏合剂
2. D 解析:HCl 、Cl2均会与碱石灰反应,NH3会与浓硫酸反应,NO既不会与碱石灰反应也不会与浓硫酸反应
3. B 解析:Cl2 和SO2均具有漂白性,活性炭具有吸附作用,它们都能使品红溶液褪色
4. B 解析:看反应过程中是否有元素化合价发生变化
5. B.
6. C 解析:依次发生下列变化:4Na + O2 ==== 2Na2O Na2O + H2O === 2NaOH
2NaOH+ CO2+ 10H2O ==== Na2CO3·10H2O Na2CO3·10H2O==== Na2CO3+ 10H2O
7.C
8.D解析:由于亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2相结合的能力。服用维生素C可缓解亚硝酸盐的中毒,是将Fe3+离子重新转变为Fe2+离子,这说明维生素C具有还原性。
9.C 提示:IBr与H2O的反应是复分解反应,IBr中+1价I有较强的氧化性。
10. B 解析:依次发生下列反应:CuSO4 + Fe===Cu + FeSO4 2FeCl3+ Fe===3 FeCl2
H2SO4 + Fe=== FeSO4 + H2↑ 2HCl+ Fe===FeCl2 + H2↑
11. B
12. D
13. A
14.C 解析: 二氧化氮遇水发生反应:3NO2+H2O===2HNO3+NO
15. D 解析: FeCl3溶液加入四种溶液中依次出现的现象是:无明显现象、溶液呈红色、生成红褐色沉淀、白色沉淀
16.C
17.B
18. D 解析:书写离子方程式时易溶于水且易电离的物质写离子,把单质、氧化物、气体、弱酸、弱碱和水等难电离物质和难溶物质用化学式表示,A中亚硫酸钠应写成离子形式,B中碳酸钙为难溶物质应写化学式,C中稀硫酸应写离子形式。D中硫酸溶液与氢氧化钠均应写离子形式
19. D 解析:因氢氧化铝溶于强酸和强碱,只能用弱碱氨水来沉淀Al3+离子
20.B解析:酸性干燥剂有浓H2SO4、P2O5等,不能干燥碱性气体NH3。碱性干燥剂有碱石灰(NaOH、CaO),固体NaOH等,不能干燥酸性气体。浓H2SO4还属于强氧化性干燥剂,不能干燥H2S、HBr、HI等还原性气体。
21.B解析::![]() (NH3)=0.0040 mol/(L·s)
(NH3)=0.0040 mol/(L·s)![]() (O2)=0.0050 mol/(L·s)
(O2)=0.0050 mol/(L·s)
![]() (H2O)=0.36 mol/(L.min)
(H2O)=0.36 mol/(L.min)
二、填空题
22、(8分)31.25;34.7%;1.80;17.35mol/L
三、推断题
23.(5分)X:H Y:O Z:Cl XZ:HCl X2Y:H2O
24、(7分)(1)A:Al; C:![]() ; I:
; I:![]()
(2)![]() ;
; ![]()
四、实验题
25.(7分)C+2H2SO4==CO2↑+2SO2↑+2H2O 强氧化性 ①检验SO2
②氧化除去SO2 ③检验SO2是否除净 ④检验CO2
五、计算题
26.(5分)答案:1.25mol/L 16.1%
解:因稀硫酸是足量的,硫酸锌的物质的量浓度根据锌的量来算
n(Zn)= 6.5g/65( g·mol-1)=0.1 mol
C(ZnSO4) =0.1 mol/[80mL/1000 (mL·L-1)]= 1.25mol/L
硫酸锌的质量分数: [0.1 mol×161 g·mol-1/(80mL ×1.25g/mL) ] ×100﹪=16.1%
答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L,质量分数为16.1%