高二化学上册实验班期中考试试卷
化 学
![]() 分值:110分
时间:90分钟 命题人:天门中学 李文才
分值:110分
时间:90分钟 命题人:天门中学 李文才
注意:请将1—23题答案填入答题卷。
可能用到的相对原子质量:H—1 C—12 O—16
Na—23 Al—27
第Ⅰ卷 (选择题 共51分)
每小题只有一个选项符合题意(3分×17=51分)
1. 下列金属冶炼的反应原理,错误的是
( ) A.Na+KCl![]() NaCl
+ K(g) B.Al2O3 + 3H2
NaCl
+ K(g) B.Al2O3 + 3H2![]() 2Al
+ 3H2O
2Al
+ 3H2O
C.Fe3O4 + 4CO![]() 3Fe
+ 4CO2 D.2Ag2O
3Fe
+ 4CO2 D.2Ag2O![]() 4Ag
+ O2↑
4Ag
+ O2↑
2. 下列各物质的名称正确的是 ( )
A.3,3-二甲基丁烷 B.1,2,3-三甲基丁烷
C.2,2-甲基-3-乙基戊烷 D.2,3-二甲基-4-乙基己烷
3. 下列各组物质中,所含相同元素的质量分数相同,但它们既不属于同分异构体,也不属于同
系物的是 ( )
A.乙烯 丙烯 B.丙烯 环丙烷
C.苯 苯乙烯 D.甲烷 乙烯
4. 关于实验室制乙烯的实验,下列说法正确的是 ( )
A.反应物是乙醇和过量的3mol/L硫酸的混合液
B.反应完毕应先熄灭酒精灯,再从水中取出导管
C.反应容器中应加入碎瓷片
D.温度计插入反应液液面下,控制温度140℃
5. 下列说法正确的是 ( )
A.生铁的熔点比纯铁高
B.在潮湿的空气中纯铁比生铁易腐蚀
C.镁的蒸气最好不要在CO2中冷却
D.FeCl2不能由化合反应得到
6. 下列各组离子在溶液中能大量共存,加入FeCl3后仍能大量共存的是 ( )
A.Na+、I-、CO32-、ClO- B.Fe2+、H+、K+、NO3-
C.Cu2+、Mg2+、Cl-、NO3- D.Ba2+、Na+、SCN-、Cl-
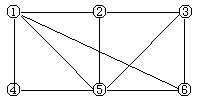 7. 如图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨能还原氧化铁):a. Al b.Fe2O3 c.NaOH溶液
7. 如图所示,6个编号分别代表下列物质中的一种物质,凡是用直线相连的两种物质均能发生化学反应(已知高温下氨能还原氧化铁):a. Al b.Fe2O3 c.NaOH溶液
d. HI溶液 e.NH3 f.Cl2
图中⑤表示的物质是 ( )
A.a或b B.c C.d D.e或f
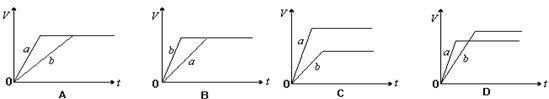
8. 将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少
量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是 ( )
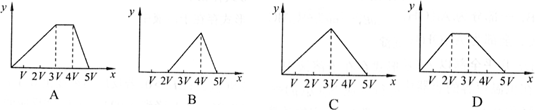
 9. 将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是 ( )
9. 将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是 ( )
10. 有六种物质:①甲烷、②苯、③聚丙烯、④环己烷、⑤2-丁炔、⑥二甲苯,既能使酸性KMnO4
溶液褪色,又能与溴水反应使之褪色的是 ( )
A.②③⑤⑥ B.③④⑤⑥ C.③⑤ D.⑤
11.下列有关说法错误的是 ( )
A.相同质量的CH4、C2H4、C2H2完全燃烧时消耗氧气质量的关系为CH4 > C2H4 >C2H2
B.对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
C.对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,完全燃烧后产生的CO2物质的量也不改变
D.某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,则该有机物的类型肯定为烷烃
12. 研究发现,烯烃在合适催化剂作用下双键可断裂,两端基团重新组合为新的烯烃。
若CH2=C(CH3)CH2CH3与CH2=CHCH2CH3的混合物发生该类反应,则新生成的烯烃的种数为(不考虑顺反异构) ( )
A.3 B.4 C.5 D.6
13. 下列有关甲苯的实验事实中,能说明苯环对侧链性质产生影响的是 ( )
A.甲苯燃烧产生带浓烟的火焰
B.甲苯能使酸性KMnO4溶液褪色
C.甲苯的硝化反应生成三硝基甲苯
D.甲苯能与H2发生加成反应
14. 下列说法正确的是 ( )
A.苯和液溴在FeCl3作催化剂时可以发生加成反应
B.苯的硝化反应属于取代反应
C.由苯制溴苯时,应该将温度计插入反应混合液中
D.溴水不能鉴别苯和硝基苯
15. 有三种不同的基团,分别为-X、-Y、-Z,若同时分别取代苯环上的三个氢原子,则生成的同分异体的数目是 ( )
A.10 B.6 C.5 D.4
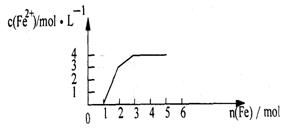 16.某稀溶液中含有Fe(NO3)3 、Cu(NO3)2 、HNO3,
16.某稀溶液中含有Fe(NO3)3 、Cu(NO3)2 、HNO3,
若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入
铁粉的物质的量之间的关系如右图所示。则稀溶
液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度
之比为 ( )
A.1:1:1 B.1:3:1 C.1:1:4 D.3:3:8
17. 向100mL0.25mol/LAlCl3溶液中加入金属钠,完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是 ( )
A.0.575g B.1.15g C.2.3g D.3.45g
第Ⅱ卷 (非选择题 共59分)
18.(8分) 甲、乙、丙为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子。
(1) 丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体A,A与氢气按1:1(物质的量之比)反应B。
①生成A的化学方程式为____________________________________________;
②A转化为B是___________反应(填反应类型);
③B是重要的工业原料,用化学方程式表示B的一种重要的工业用途,反应的化学方程式是
。
(2)Mg在一定条件下_________(填“能”或“不能”)和甲、乙、丙中的一种或几种反应。若能,则反应的化学方程式是____________________________________________(若不能,此空不作答)。
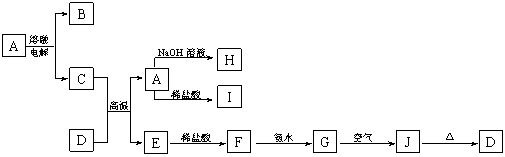
19.(10分) A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已
知A是由两种元素形成的化合物,D是一种红棕色固体,H的焰色反应呈黄色。
 |
请回答下列问题:
(1)B物质的化学式为_________,H物质的名称为________________。
(2)G→J的化学方程式为___________________________________。
(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):_______________。
(4)E在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:___________________。
(5)写出一个满足下列两个条件的置换反应:_______________________________________。
①在A——J中找一种单质作为反应物;
②生成物之一是具有磁性的氧化物。
20. (11分)教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。
已知:Al、Fe的熔点、沸点数据如下:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
(1)引发铝热反应的实验操作是:_______________________________________________。
(2)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放热能使铁熔化,
而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?
(填“合理”或“不合理”)。
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝。请填写下列表格:
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的离子方程式 |
21.(12分) 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验中模拟上述过程,其设计的模拟装置如下:
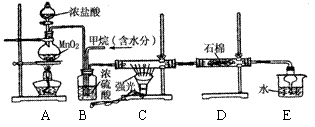
(1)B装置有三种功能:①________________;②_______________;③______________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值的取值范围为_________。
(3)D装置的石棉中均匀混有KI粉末,其作用是__________________________________。
(4)E装置的作用是______________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_________________________________________。
(6)该装置还有缺陷,原因是没有进行尾气处理,尾气主要成分除CH4外,还有________(填编号)
A.CH3Cl B.CH2Cl2 C.CHCl3 D.CCl4
22. (10分) 分子式为C6H12的某烯烃有多种同分异构体,其中有一种分子结构中所有的碳原子都在同一平面上,该烯烃的结构简式是____________________________;另有四种该烯烃的同分异构体经催化加氢后能得到同一种烷烃,则该烷烃主链上有_____个碳原子;再有三种该烯烃的同分异构体加氢后亦能得到同一种带有甲基支链的烷烃(与前者不同),这三种烯烃的结构简式分别是:
________________________ 、________________________ 、__________________________。
23.(8分) 根据烷、烯、炔烃燃烧的反应式,有人总结出以下规律:
对于烷烃有n(烷烃)=n(H2O)-n(CO2);
对于烯烃有n(H2O)-n(CO2) =0;
对于炔烃有n(炔烃)= n(CO2)-n(H2O)。
请回答下列问题:
(1)某混合气体由C2H6和C3H4组成。将1.0L混合气体在氧气中充分燃烧,产生CO2的体积比水蒸气多0.2L(相同状况下测定),通过计算确定C2H6和C3H4的体积。
V(C2H6)=________________;V(C3H4)=________________。
(2) 某混合气体由烯烃和烷烃或烯烃和炔烃组成。组成中可能是两种气体,也可能是多种气体。将1.0体积混合气体在氧气中充分燃烧,产生3.0体积CO2和2.4体积水蒸气 (相同状况下测定)。
①判断混合气体由______________________两类烃组成。
②上述两类烃的体积比为____________________________。
高二实验班期中考试化学试题
参考答案
单选题(3分×17=51分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | B | D | C | C | C | C | C | D | A | D | D | B | B | B | A | C | C |
非选择题(共59分)
![]() 18.(8分) (1)①CaC2+2H2O C2H2↑+Ca(OH)2(2分)
18.(8分) (1)①CaC2+2H2O C2H2↑+Ca(OH)2(2分)
②加成(1分)
![]() ③nCH2=CH2
③nCH2=CH2![]()
![]() CH2-CH2
CH2-CH2![]() 或CH2=CH2+H2O
或CH2=CH2+H2O![]() CH3CH2OH(写任一个合理的反应式均可)(2分)
CH3CH2OH(写任一个合理的反应式均可)(2分)
(2)能(1分) 3Mg+N2 Mg3N2(2分)
19.(10分)(1)O2(1分);偏铝酸钠(1分) (2)4Fe(OH)2+2H2O+O2═4Fe(OH)3(2分)
![]() (3)Fe3++3H2O
(3)Fe3++3H2O![]() Fe(OH)3+3H+(2分)
Fe(OH)3+3H+(2分)
(4)2H2O+ O2+4e-=4OH-(2分) (5)3Fe+4H2O Fe 3O4+4H2(2分)
20. (11分)(1)加少量KClO3,插上Mg条并将其点燃(2分) (2)合理(2分)
(3)
| 所用试剂 | NaOH溶液(1分) |
| 实验操作及现象 | 取少量样品放入试管,加入NaOH溶液,(2分) 若有气泡产生,说明该熔融物中有铝。(2分) |
| 有关反应的离子方程式 | 2Al+2OH-+2H2O=2AlO2-+3H2↑ (2分) |
21.(12分) (1)①控制气流速度 ②均匀混合气体 ③干燥混合气体(3分)
(2)x≥4 (2分) (3)吸收过量的氯气(2分) (4)C、D(2分)
(5)CH4+2Cl2![]() C+4HCl(2分) (6)A(1分)
C+4HCl(2分) (6)A(1分)
22.(10分) (CH3)2C=C(CH3)2 (2分) 5 (2分)
CH3CH=C(CH3)CH2CH3(2分) CH2=CHCH(CH3)CH2CH3(2分) CH2=C(CH2CH3)(2分)
23.(8分) (1)V(C2H6)= 0.4L(2分);V(C3H4)= 0.6L(2分)。
(2)①烯烃和炔烃(2分) ②V(烯烃):V(炔烃)=2:3(2分)