高二化学上册期末试题
第一卷 选择题
可能的相对原子质量:H-1 C-12 O-16 S-32 N-14 Ba-137
一、选择题(本题共10小题,每个小题只有一个正确答案)
1.在预防SARS时,医学专家告诉我们对公共场所要进行消毒;毛巾、口罩要经常用开水蒸煮;被褥要放在太阳光下直射,其目的是
A.使多糖水解 B.使油脂水解 C.使氨基酸变性 D.使蛋白质变性
2. 由两种原子组成的纯净物
A.一定是化合物 B.可能是单质,可能是化合物
C.一定是单质 D.一定是同素异形体
3.想一想,NaOH(固)、P2O5(固)、CaCl2(无水)为什么可以归为一类。据此,与这三种物质可归为一类的是
A.H2SO4 B.NaCl C.碱石灰 D.CaO
4.在pH=1的无色透明溶液中能大量共存的离子组是
A.Al3+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、S2-、Cl- D.Fe3+、Na+、NO3-、SO42-
5.下列有机物在酸性催化条件下发生水解反应,生成两种不同的有机物,且这两种有机物的相对分子质量相等,该有机物是①蔗糖 ②麦芽糖 ③丙酸乙酯 ④丙酸丙酯
A.①③ B. ②④ C. ①④ D. ②③
6.下列物质中,均直接由原子构成的是
①二氧化碳②二氧化硅③钠蒸气④金刚石⑤单晶硅⑥白磷⑦硫⑧氨⑨溴化氢⑩碘蒸气
A.①⑥⑩ B.②③④⑤ C.①⑦⑧ D.⑧⑨⑩
7.分子式为C8H16O2的有机物A,能在酸性条件下水解,生成有机物B和C,且B在一定条件下可转化为C。则有机物A可能的结构有
A.2种 B.4种 C.8种 D.16种
8.下列各组物质等质量燃烧时产生的CO2相同的是①C2H4、C2H5OH②CH2O、C6H12O6③CH3COOH、HCOOCH3④C14H30、C14H14O
A.②③④ B.①②③④ C.①② D.②③
9.下列离子方程式正确的是
A. 氯气通入水中:Cl2+ H2O= 2H++ Cl-+ ClO-
B. Ba(OH)2溶液与MgSO4溶液混合:Ba2++ SO42-= BaSO4↓
C. 向澄清的石灰水中加入少量NaHCO3溶液:Ca2++ 2OH-+ 2HCO3-= CaCO3↓+ CO32-+ 2H2O
D. CaCO3与稀盐酸反应:CaCO3+ 2H+= Ca2++ CO2↑+ H2O
10. 某强氧化剂XO(OH)2+ 被亚硫酸钠还原到较低价态。如果还原2.4×10-3 mol XO(OH)2+ 的溶液到较低价态,需用30ml 0.2mol/L的Na2SO3 溶液,那么X元素的最终价态为
A.+2 B.+1 C.0 D.-1
二、选择题(本题共6小题,每小题有1~2个正确答案)
11.某C、H、O、N四元素组成的化合物,其一个分子中含有的原子数分别为a、b、c、d,则下列等式一定正确的是
A. b≤2a+2 B.b≤2a+2+d C.c≤a D.d≤a
![]()
![]() 12. 由有机物CH≡CH、HCN、CH3COOH合成高分子[CH2-CH(CN)CH2CH(OOCCH3)]n,则反应类别是
12. 由有机物CH≡CH、HCN、CH3COOH合成高分子[CH2-CH(CN)CH2CH(OOCCH3)]n,则反应类别是
A.加成、酯化、加聚 B.加成、加成、加聚 C.加成、消去、加聚 D.加成、取代、加聚
13.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是
A.稀盐酸,Na2CO3溶液 B.Cu,FeCl3溶液
C.稀H2SO4溶液,NaAlO2溶液 D.浓氨水,AgNO3溶液
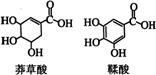 14. 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
14. 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
15.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3
![]() 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 ![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
A.C3N3(OH)3与HNCO最简式相同 B.反应中NO2是还原剂
C.HNCO是一种很强的氧化剂 D.1molNO2在反应中转移的电子为4mol
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
第二卷 非选择题
17. (1)下列操作不正确的是(多选倒扣分)__________________
A.用渗析法分离淀粉中混有的NaCl杂质
B.用酒精清洗附着有碘晶体的试管
C.将金属钠放在煤油中保存
D.苯中溶有苯酚杂质,可向其中加入适量的浓溴水,然后过滤
E.用分液漏斗分离乙醛和水的混合物
(2)某课外活动小组证实有机物CH2=CHCHO含碳碳双键。经查阅资料得知溴水能氧化醛基,实验步骤是①取10%的NaOH溶液5mL,滴入2%CuSO4溶液6滴,振荡后加入该有机物10滴,加热,现象是 ;② 取实验①后上层溶液加入溴水,振荡溶液溴水迅速褪色。
该小组报告称达到实验目标。你的评价是:
。
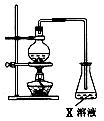 18.酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。如图装置是乙酸乙酯的实验室和工业制法常采用如下反应:
18.酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。如图装置是乙酸乙酯的实验室和工业制法常采用如下反应:
请根据要求回答下列问题:
(1)烧瓶中主要的制备反应是 ;装置中X的化学式是 。
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为 、 等。如何提高乙酸乙酯的产率,请提出一个方案 。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| ★选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
19.A、B、C、D、E五种短周期元素,原子序数依次增大,A、E元素在同一主族,A阳离子是一个质子,B原子最外层s、p能级电子数相等,A、D元素可形成多种化合物。
回答下列问题:
(1)E在周期表中的位置是 ,B的电子排布式是 ;
(2)以上元素可以组成多种10电子和18电子微粒。
①写出10电子阳离子的化学式: (写3种)
②写出18电子分子或离子的化学式: (写3种)
(3)以上元素可以组成多种电解质,它们水溶液有的呈现一定的酸碱性。
①溶液呈酸性,该电解质的化学式: (写3种)
②溶液呈碱性,该电解质的化学式: (写3种)
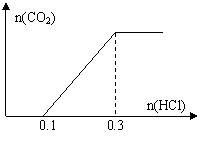 |
20.(1) 一定量的碳酸钠、碳酸氢钠、氢氧化钠组成的混合物,
溶解于水后溶液中的溶质成分可能是
① ,② ③ ;
若在该溶液中加入盐酸其图像如图,则溶质的成分应是
(填①②③编号),发生的离子方程式是 ;
(2)某氧化还原反应过程中有下列物质组成:CrCl3、Cl2、
K2Cr2O7、HCl、H2O,请写出反应的化学方程式
,其中氧化剂是 ,被氧化的元素是 ,转移6mol电子时,生成的氧化产物 mol。
21.A、B两种有机物的结构简式如图:CH3CH(R)COOH,R表示某种官能团。A的式量是90,B的式量是89。
(1)A、B分子中不同官能团的名称分别是 和 ,均 (选填“含”或“不含”)手性碳原子;
(2)A的某种同分异构体核磁共振氢谱有一种吸收峰,则该有机物的结构简式是 ,B的某种同分异构体核磁共振氢谱有两种吸收峰,其强度比是1:6,则该有机物的结构简式是 ;
(3) A、B的两个分子之间发生反应失去一个水分子,则生成物的结构简式是
或 。
22.法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成。Grignard试剂的合成方法是:RX+Mg![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
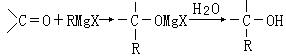
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。
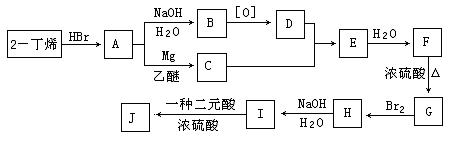
请按要求填空:
(1)F的结构简式是 ;
(2)C+D→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
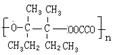
(4)I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式 。
23.某化学兴趣小组取1mol KMnO4样品(假设是纯净物),加热部分分解,得到a mol O2,残留固体与足量的浓盐酸充分反应,得到b molCl2,又知锰元素全部转化为 Mn2+。
(1)该小组的某同学甲未通过复杂计算判断出反应消耗的作为酸的盐酸溶质物质的量n(HCl)(不计还原剂的量)为定值,这一判断可能吗? (选填“可能”或 “不可能”),若选填不可能,则以下两格不填;若选可能,则分析甲同学判断依据是 ,且n(HCl)= mol;
(2) 该小组分析得到a、b的关系式,则关系式是 ;
且a+b的最大值为 。
24.煤的气化这一重要的绿色化学技术在国外得到很大的发展,虽然在我国的研究工作刚刚起步,但是仍取得了令世人刮目相看的成果。煤的气化过程主要包括热解、气化和燃烧。主要反应[以长烟煤(C10000H8470O794)为例]:2CHxOy→2(1-y)C+2yCO+xH2
(1)上述方程式中x= ,y= ;
(2)上述反应产物中CO和H2是化工生产的原料气。现有1t长烟煤(令C10000H8470O794的式量为M、下同)按上式进行.
若煤的转化率为90%,可生成原料气 t(可以仅列出计算式、下同);
若用CO和H2在催化条件下生成C6的烷烃,这是人工合成汽油的方法之一,碳原子全部用于合成汽油,假设碳原子的利用率为a,则1t长烟煤生产烷烃 t;
答题卷
说明:用2B铅笔将选择题的正确答案涂在答题卡上。
17.(1)
(2) ,
。
18.(1) , ;
(2) 、 ,
;
(3) 、 ,
① ②
19.(1) 、
(2)① 、 、
② 、 、
(3)① 、 、
② 、 、
20.(1)① ② ③ ,
, ;
(2) ,
、 、 。
21.(1) 、 、 ;
(2)
(3)
22.(1) ,
(2) 、 ;
(3) ,
。
(4)
23.(1) ,
,n(HCl)= ;
(2) , 。
解题过程:
24.(1)x= ,y= ;
(2) 、 。
解题过程:
参考答案
1-10每小题3分,11-16每小题4分共54分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | B | D | B | A | B | A | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | D | B | B | B | AD | AD | AC |
|
18(共10分)(1)CH3COOH+CH3CH2OH → CH3COOCH2CH3+H2O(2分),Na2CO3(1分)
(2)原料来不及反应被蒸出 温度过高发生副反应 冷却效果不好,部分产品挥发,( 任选两个答案) (2分);接冷凝管提高冷却效果。(其它正确答案也给分,下同)(1分)
(3)产生大量酸性废液,污染环境 有机物炭化 催化剂重复使用困难,催化效果差 副反应多(任选两个答案)①C ②乙醇生成乙醚等副反应发生。(各1分 共4分)
19(共14分)(1)第三周期IA族,1s22s22p2 (2) ①Na+、H3O+、NH4+②H2O2、N2H4、C2H6、CH4O、、O22- (任选3个,下同)(3) ①H2CO3 、HNO3、HNO2、NH4NO3、CH3COOH等②Na2CO3、NaHCO3、NH3·H2O、NH4CN等。(各1分 共14分)
20(共11分)(1)①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3, ③(注意配伍),CO32-+H+=HCO3-, HCO3-+H+=CO2↑+H2O (各1分 共6分)
(2)K2Cr2O7+14HCl=2CrCl3+3Cl2↑+2KCl+7H2O(2分), K2Cr2O7 ,Cl,3。(各1分 共3分)
21(共7分)(1)羟基、氨基,含(2)CH3OCOOCH3或(CH2O)3,CH3CH(NO2)CH3
(3)HOOCCH(CH3)OOCCH(CH3)NH2, HOOCCH(CH3)NHOCCH(CH3)OH(各1分 共7分)
22(共7分)(1)CH3CH2C(CH3)(OH)CH(CH3)CH2CH3 (2)加成、消去
|
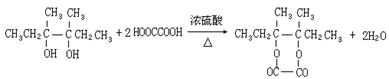 (4)
(4)
(方程式各2分,其余各1分,共7分)
23(共6分)(1)可能(1分),依据元素及其元素配比守恒,产物是KCl和MnCl2中的Cl-即来自于酸的盐酸(1分);3mol(1分) (2)4a+2b=5(2分),2.5(1分)
24(共6分)(1)x=0.8470 y=0.0794(2分)
(2)10000[0.0794×28+0.8470]×0.9/M,0.0794×86×10000a/6M(4分)