高二化学上学期测验试卷
(试卷满分为100分,考试时间为100分钟)
原子量:H-1 C-12 N—14 O-16 Na-23 P-31 Cl-35.5
Fe-56 Cu-64 Ag-108
一.选择题(每小题只有1个选项符合题意,每小题2分,共20分)
1.下列物质属于非电解质的是
A.醋酸钠晶体 B.二氧化碳 C.金属铜 D.冰醋酸
2.所含微粒种类最多的液体是
A.液氨 B.液氯 C.氨水 D.盐酸
3.设C(固)+CO2![]() 2CO(正反应为吸热反应)正反应速率为υ1 ,N2+3H2
2CO(正反应为吸热反应)正反应速率为υ1 ,N2+3H2![]() 2NH3(正反应为放热反应) 正反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为
2NH3(正反应为放热反应) 正反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
4.NH4Cl溶于重水(D2O)中,生成一水合氨和水合氢离子的化学式是
A.NH3·D2O和HD2O+ B.NH3·HDO和D3O+
C.NH2D·D2O和DH2O+ D.NH2D·HDO和D3O+
5.室温下,把1mL 0.1mol/L的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+浓度接近于
A.1×10—4 mol·L—1 B.1×10—13 mol·L—1
C.1×10—11 mol·L—1 D.1×10—10 mol·L—1
6.能说明一水合氨(NH3·H2O)是弱电解质的事实是
A.氨水有挥发性 B.氨气极易溶于水制得氨水
C.1mol/L的氨水的pH约为10 D.氨水与AlCl3溶液反应生成沉淀
7.在25℃时,1mol/L 的NH4Cl 、CH3COONH4 、NH4HSO4、NH4HCO3的溶液中,测得其NH4+浓度分别为a、 b、 c、d(单位为mol/L),下列判断正确的是(相同条件下氨水和醋酸的电离程度相同)
A.a = b = c=d B.a = c>b=d C.c> a>d> b D.c > a > b>d
8.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Mg2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
9.中和相同体积,相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则
A.V3>V1=V2 B.V3>V2>V1 C.V1>V2>V3 D.V3<V1=V2
10.能使H2O![]() H++OH-电离平衡向正向反应方向移动,而且所得溶液呈酸性的是:
H++OH-电离平衡向正向反应方向移动,而且所得溶液呈酸性的是:
A.将水加热到100℃,使水pH=6 B.在水中滴入稀H2SO4
C.在水中加入小苏打 D.在水中加入氯化铜
二.选择题(每小题有1—2个选项符合题意,每小题2分,共24分)
11.下列反应中,气体反应物只做氧化剂的是
A.Cl2通入石灰水中 B.CO2通入Na2CO3溶液
C.F2与H2O反应 D.NO2与H2O反应
12.下列事实不能用化学平衡移动原理解释的是
A.收集氯气用排饱和食盐水的方法
B.加催化剂,使N2和H2在一定的条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.加压条件下有利于SO2和O2反应生成SO3
13.pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+) 为 (mol/L)
A.1/5(4´10-9 + 1´10-12) B.1/5(8´10-9 + 1´10-12)
C.5´10-10 D.5´10-12
14.下列溶液,一定呈中性的是
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.c(H+)=1×10-7mol/L的溶液 C.pH=14-pOH的溶液
D.pH=pOH的溶液
15.有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是 ③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
16.一定温度下,某密闭容器中发生如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)(正反应为吸热反应),当反应达到平衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其它条件不变时,下列措施中可采用的是①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2 ④再加入2n
molCO和2n mol H2O(g)
CO2(g)+H2(g)(正反应为吸热反应),当反应达到平衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其它条件不变时,下列措施中可采用的是①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2 ④再加入2n
molCO和2n mol H2O(g)
A.①② B.②④ C.③④ D.①②③
17.将8molH2和2molN2充入2L密闭容器中,在一定条件下进行合成氨的反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是
A.υ(H2)=0.3mol·L—1·min—1 B.H2的转化率为25%
C.平衡时,NH3的物质的量浓度为0.8mol/L
D.反应前后的压强比为25:21
18.在容积固定的密闭容器中存在如下反应:A(g)+3B(g) ![]() 2C(g);(正反应放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);(正反应放热反应)。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
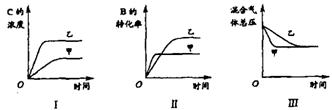
下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
19.用水稀释0.1mol/L的醋酸溶液,其中随水的增加而最终增大的有
①H+的物质的量 ②c(H+) ③c(OH—) ④
![]() ⑤
⑤![]()
A.①③④ B.①③⑤ C.②④ D.③④
20.已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是A.在Na2A、NaHA两溶液中,离子种类不相同
B.HA—的水解离子方程式为:HA—+H2O![]() H3O++A2—
H3O++A2—
C.在Na2A溶液中一定有:c(OH-)= c(H+)+ c(HA—) +c(H2A)
D.在NaHA溶液中一定有:c(Na+)+ c(H+)=c(HA—)+c(OH-)+2c(A2—)
21.常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≥20mL D.V总≤20mL
22.常温下,0.1mol/L的一元酸HA溶液其pH>1,而0.1mol/L的一元碱BOH的溶液中c(OH-)/c(H+)=1012,将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(OH-)<c(H+)<c(A-)<c(B+)
C.c(H+)<c(OH-)<c(A-)<c(B+) D.c(OH-)=c(H+)> c(B+)=c(A-)
三.填空题
23.(6分)已知某溶液中只含有OH—、H+、NH4+、Cl— 四种离子。
(1)若溶液中只溶解了一种溶质,则该溶质是_______________________。
(2)若溶液中c (NH4+)>c (Cl—)>c (OH—)>c (H+),则含有的溶质是 _______________________。
(3)若溶液是由体积相等的盐酸和氨水混合而成,且恰好呈中性,则混合前c (NH3·H2O)_________c (HCl)(填“<”、“>”或“=”)。
24.(6分)关于下列两个反应:
①0.1mol/L醋酸溶液:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
②0.1mol/L醋酸钠溶液:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(1)两式到达平衡后,加入一定量的水后,平衡向右移动的是_______,溶液的pH增大的是______(此问填序号)。
(2)向②反应中加入少量的醋酸钠固体,溶液的pH将________(填增大、减小、不变),若加入少量的CH3COOH,使溶液中c(Na+)=c(CH3COO-)则溶液的pH为_______(填数值)。
(3)若向①反应中加入少量的冰醋酸,溶液的pH将_______,电离程度将____ (填增大、减小、不变)
25.(6分)(1)将位于同一周期的主族元素A和B的氯化物AClX和BClY配制成等物质的量浓度的溶液,测得AClX溶液的pH小于BClY溶液的pH。试判断A、B两元素原子序数的大小关系_________
(2)pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后,溶液呈酸性。
①反应所生成的正盐的化学式为__________
②该盐中________离子一定水解,水解的离子方程式为__________
26.(10分)在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(气)+H2O(气)![]() CO2(气)+H2(气)(正反应是放热反应)
CO2(气)+H2(气)(正反应是放热反应)
(1)改变条件,能使正反应速率增大的是 (填序号)
A.降温 B.加压 C.增大CO2的浓度 D.使用催化剂
(2)CO和H2O浓度变化如下图,则0-4min的平均反应速率v (CO)= mol/(L·min)
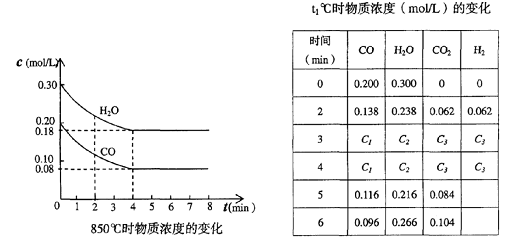
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min-5min间,平衡向逆方向移动,可能的原因是________,表中5min-6min之间数值发生变化,可能的原因是__________。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
四.推断题
27.(8分)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一,C、D、E、F都是单质。
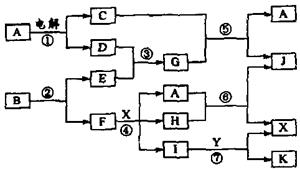
请按要求填空:
(1)写出下列物质的化学式:A: ,E: F: ,Y: 。
(2)反应③的化学方程式为: 。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为: 。
五.实验题
28.(12分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):


已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
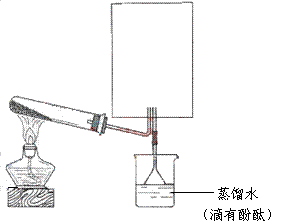

①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
六.计算题
29.(8分)将32 g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为 L,NO2的体积为 L,
(2)待产生的气体全部释放后,向溶液中加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要双氧水的物质的量为 mol。
参考答案
一、二选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| B | C | A | B | D | C | D | B | A | D | C |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| B | D | D | C | B | B | AB | A | D | AD | C |
三、填空题
23、(1)NH4Cl (2)NH4Cl NH3·H2O (3)>
24、(1)①②;① (2)增大;等于7 (3)减小;减小
25、(1)AB (2)①BmAn②An—;An—+H2O![]() HA (n—1)—+OH—
HA (n—1)—+OH—
26、(1)BCD (2)0.03mol/Lmin (3)①平衡;大于 ②d;a
四、推断题
27、(1)A:H2O E:N2 F:Ag Y:HCl
(2) ![]()
(3)AgN3
五、实验题
28、

![]() (1)
(1)
(2) ①
②NH4Cl、Ca(OH)2 (合理答案均给分)
③NH3·H2O![]() NH4++OH-
NH4++OH-
(3)PCl5
(4)P3N3Cl6
六、计算题
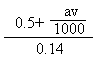 29、(1)5.6;5.6
29、(1)5.6;5.6
(2)
(3)0.5