高二理科化学上学期期末检测试卷
命题 程培红 黄山市田家炳实验中学
审题 程素芳 黄山市教育科学研究所
第I卷(选择题,共48分)
可能用到的相对原子质量:H=1 C=12 O=16 Ag=108
请将选择题答案填写在答题卡上
一、选择题(本题共16小题,每题3分,共48分。每小题只有一个选项符合题意)
1.常温下,下列变化过程不是自发的是
A.石灰石的分解 B.原电池产生电流
C.在密闭条件下体系从有序变为无序 D.铁在潮湿空气中生锈
2.下列溶液一定呈中性的是
A.pH=7的溶液 B.c (H+)=1.0×10-7 mol/L的溶液
C.c
(H+)=c (![]() ) D.pH=3的酸与pH=11碱等体积混合后的溶液
) D.pH=3的酸与pH=11碱等体积混合后的溶液
3.在一定温度下的恒容容器中,表明反应A(s)+2B(g) ![]() C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
A.混合气体的压强不随时间变化而变化
B.混合气体的密度不随时间变化而变化
C.气体总物质的量不随时间变化而变化
D.单位时间内生成n mol C,同时消耗2n molB
4.用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是:
A.稀HCl溶液 B.稀Na2SO4溶液 C.CuCl2溶液 D.酸性AgNO3溶液
5.2A(g)+B(g)![]() 3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.ν(A)=0.7 mol·L-1·min-1 B.ν(B)=0.3 mol·L-1·min-1
C.ν(C)=0.9 mol·L-1·min-1 D.ν(D)=1.1 mol·L-1·min-1
6.相同体积的pH =3的强酸溶液和弱酸溶液分别跟等质量的镁充分反应,下列说法错误的是
A.刚开始时两种溶液中产生H2的速率相同
B.若有一种溶液中镁有剩余,则有剩余的是强酸溶液
C.若两种溶液中镁均无剩余,则两者产生等量的氢气
D.若两种溶液中镁均有剩余,则两者产生等量的氢气
7.下列各组离子中,在酸性溶液里能大量共存,且溶液为无色透明的是
A.K+、![]() 、Cl
、Cl![]() 、
、![]()
![]() B.Na+、
B.Na+、![]() 、
、![]() 、HCO
、HCO![]()
C.Na+、H+、![]() 、
、![]() D.Na+、
D.Na+、![]() 、Cl
、Cl![]() 、
、![]()
8.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)===CO2 ( g ) ΔH=-393.51 kJ·mol-1
C(金刚石)+O2(g)===CO2 ( g ) ΔH=-395.41 kJ·mol-1
据此判断,下列说法正确的是
①由石墨制备金刚石是吸热反应;②由石墨制备金刚石是放热反应;③等质量时,石墨的能量比金刚石的低;④等质量时,石墨的能量比金刚石的高。
A.①③ B.①④ C.②③ D.②④
9.能正确表示下列反应的离子方程式是
A.碳酸氢钙溶液和氢氧化钠溶液混合:![]() +
+![]() ==
== ![]() +H2O
+H2O
B.碳酸钙与醋酸反应:CaCO3+2H+== Ca2+ +H2O + CO2↑
C.醋酸钠水解反应:CH3COO- + H3O+ == CH3COOH + H2O
D.硫酸铜溶液和氢氧化钡溶液混合:
Cu2++![]() + Ba2++2OH-== Cu(OH)2↓+BaSO4↓
+ Ba2++2OH-== Cu(OH)2↓+BaSO4↓
10.1 g H2完全燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是
A.2H2 + O2 == 2H2O ΔH=-571.6kJ·mol-1
B.H2(g)+![]() O2(g)== H2O( l ) ΔH=-142.9 kJ·mol-1
O2(g)== H2O( l ) ΔH=-142.9 kJ·mol-1
C.H2(g)+![]() O2(g)== H2O
(
l ) ΔH=-285.8 kJ·mol-1
O2(g)== H2O
(
l ) ΔH=-285.8 kJ·mol-1
D.2H2(g)+O2(g)== 2H2O ( g ) ΔH=-571.6 kJ·mol-1
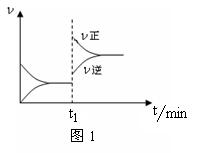 11.图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是
11.图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是
A.2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,t1时刻升高温度
2SO3(g) ΔH<0,t1时刻升高温度
B.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度
4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度
C.H2O(g)+CO(g) ![]() H2(g)+CO2(g) ΔH>0, t1时刻增大压强
H2(g)+CO2(g) ΔH>0, t1时刻增大压强
D.C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0,t1时刻升高温度
CO(g)+H2(g) ΔH>0,t1时刻升高温度
12.若在铜片上镀银时,下列叙述正确的是
①将铜片接在电源的正极上,②将银片接在电源的正极上,③在铜片上发生的反应是:Ag+ + e-= Ag,④在银片上发生的反应是:4OH――4e-= O2↑+ 2H2O,⑤需用CuSO4溶液作电解液,⑥需用AgNO3溶液作电解液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
13.下列说法正确的是
A.25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4
B.25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9
C.25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7
D.90℃时,纯水的pH=6.2,所以加热可以使水呈酸性
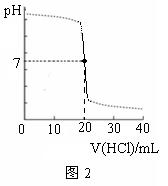 14.用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00mL,滴定曲线如图2所示。则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol·L-1)
14.用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00mL,滴定曲线如图2所示。则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol·L-1)
| A | B | C | D | |
| HCl | 0.12 | 0.10 | 0.10 | 0.08 |
| NaOH | 0.10 | 0.12 | 0.08 | 0.10 |
15.实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液
C.(NH4)2SO4粉末 D. K2SO4固体
16.为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上 B.将青铜器与直流电源的正极相连
C.将青铜器保存在潮湿的空气中 D.在青铜器的表面覆盖一层防渗的高分子膜
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题,共52分)
二、本题包括3小题,共18分
17.(5分)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
请回答下列问题:
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式:
_____________________________________________________。
⑵根据盖斯定律完成下列反应的热化学方程式:
CO(g)+2H2(g)==CH3OH(l) ΔH=________________。
18.(8分)
⑴常温下,0.10mol/LNH4Cl溶液pH____7(填>、=、<),溶液中各离子浓度由大到小的顺序是______________________________。
⑵相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小: Na2S____NaHS(填>、=、<),两种溶液中微粒种类:Na2S_______NaHS(填>、=、<)。
⑶NaHCO3溶液呈碱性的原因是________________________________(写出有关的离子方程式,下同),Al2(SO4)3溶液呈酸性的原因是________________________________,将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是___________________________,相关反应的离子方程式是________________________________。
19.(5分)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2 mol/L NaOH溶液,观察到有白色沉淀生成,该反应的离子方程式是______________________________。再滴加2滴0.1mol/L FeCl3溶液,观察到白色沉淀转化为红褐色沉淀,该反应的离子方程式是__ __________________________________________。由以上现象可以推知,相同条件下Mg(OH)2和Fe(OH)3中溶解度较大的是_________________。
三、本题包括2小题,共16分
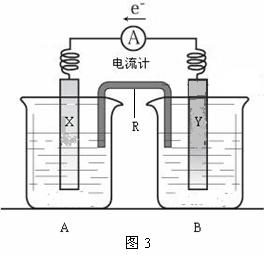 20.(7分)图3是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)== ZnSO4(aq) + Cu(s)。
20.(7分)图3是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)== ZnSO4(aq) + Cu(s)。
请回答以下问题:
⑴R的名称是____________,其作用是____________________________________。R中的阳离子移向_______(填A或B)中的溶液。
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的______极,其电极反应式是____________________________。
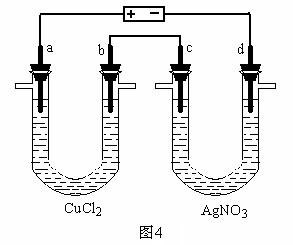 |
21.(9分) 图4是一套电解装置,两U型管中均盛有50.0 mL电解质溶液,a、b、c、d为 Pt电极。通电一段时间,d电极上析出金属Ag 2.16 g,没有气体产生。同时在b、c两极收集到标准状况下相同体积的气体。请回答:
⑴c为______极,写出c电极上的电极反应式:______________________________,c极收集到的气体体积在标准状况下为___________L。
⑵b为______极,写出b电极上的电极反应式:
开始时是 _____________________________、
后来是_________________________________。
⑶原CuCl2溶液中溶质的物质的量浓度为___________mol/L。
四、本题包括2小题,共18分
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol
2NH3(g) ΔH=-92.4kJ/mol
据此回答以下两题。
22.(7分)⑴合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是________(填序号)。
①20MPa~50MPa ②500℃的高温 ③铁触媒作催化剂
 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中
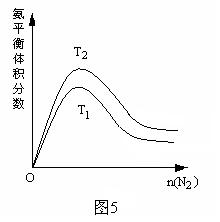
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图5所示 (T-温度)。则T2_____T1 (填>、=、<),判断的依据是:
_________________________________________________________________________________。
⑶相同温度下,有恒容密闭容器A、恒压密闭容器B, 两容器中均充入1molN2和3molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a ,放出热量Q1kJ;B中NH3的体积分数为b ,放出热量Q2kJ。则:
a_____b(填>、=、<),Q1_____ Q2(填>、=、<),Q1_____92.4(填>、=、<)。
23.(11分)
⑴化学平衡常数K表示可逆反应的进行程度,K值越大,说明___________(填正、逆)向反应进行程度越大;当反应物或生成物浓度变化时,K______________(填增大、减小、不变)。
⑵一定条件下合成氨反应的平衡常数表达式为
|
温度升高,合成氨反应的K将_____________(填增大、减小、不变)。
⑶若合成氨反应达到平衡时, c(N2) = 3mol/L, c(H2) = 9mol/L,c(NH3) = 4mol/L。则起始时
 |
c(N2) =________ mol/L,平衡时H2的转化率为____________。
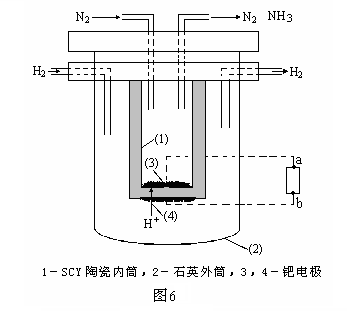
⑷1998 年两位希腊化学家 George Marnellos 和 Michael Stoukides 发明一种合成氨新方法。在常压下 , 将 H2 与用 He 稀释的 N2 分别通入一加热到 570℃ 的以锶-铈-钇-钙钛矿多孔陶瓷 (SCY) 为固体电解质的电解池中,用覆盖在固体电解质内外表面的多孔钯多晶薄膜催化,转化为氨,H2转化率达到 78%。实验装置如图6所示。通电后,H2发生的电极反应式为:H2-2e-=2H+,则图中电源a为_____极,N2参加的电极反应式为:
________________________。
参考答案
一、选择题,每题3分,共48分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | C | B | B | A | D | C | A | D | C | D | B | B | C | A | D |
二、共18分
17.5分
⑴CH3OH(l)+![]() O2(g)==CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1 2分
O2(g)==CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1 2分
⑵-128.1 kJ·mol-1 3分
18.8分,每空1分
⑴ < c(Cl![]() )>c(
)>c(![]() )>c(H+)>c(OH-) ⑵ > =
)>c(H+)>c(OH-) ⑵ > =
⑶ ![]() + H2O
+ H2O ![]() H2CO3
+ OH- Al3++3H2O
H2CO3
+ OH- Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
有白色沉淀和无色气体产生 Al3++3![]() ==Al(OH)3↓+ 3CO2↑
==Al(OH)3↓+ 3CO2↑
19. 5分
Mg2+ +2![]() ==
Mg(OH)2↓ 2分
==
Mg(OH)2↓ 2分
3Mg(OH)2 + 2Fe3+ == 3Mg2+ + 2Fe(OH)3 2分 Mg(OH)2 1分
三、共16分
20. 7分 每空1分
⑴盐桥 使两个烧杯中的溶液连成通路 A
⑵Zn ZnSO4 溶液 ⑶正 Cu2++2e-== Cu
21.9分
⑴ 阳 4OH-- 4e-=2H2O+O2↑ 每空1分 0.112 2分
⑵ 阴 Cu2++2e-=Cu 2H++2e-=H2↑ 每空1分
⑶ 0.10 2分
四、共18分
22. 7分
⑴ ②③ 2分
⑵ < 合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2 每空1分 (其它合理答案同样给分)
⑶ < < < 每空1分
23.11分
⑴ 正 不变 每空1分
|
|
⑶ 5 40%(或0.4) 每空2分
⑷ 负 1分 N2 + 6H+ + 6e-=2NH3 2分