高二理科化学上学期期末考试卷
一、选择题(本题包括23小题,每小题2分,共46分。每小题只有 1 个选项符合题意)
01.氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
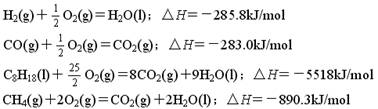
氢气、一氧化碳、辛烷、甲烷的热值最小的是 ( )
A.H2(g) B.CH4(g) C.C8H18(l) D. CO(g)
 2.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
(
)
2.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
(
)
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
3.关于右图装置的叙述中,正确的是 ( )
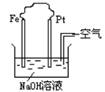 A.这是电解NaOH溶液的装置
A.这是电解NaOH溶液的装置
B.这是一个原电池反应装置
C.Pt为正极,其电极反应为:2H++2e=H2↑
D.Fe为负极,其电极反应为:4OH--4e-=2H2O+O2↑
4.下列反应的离子方程式书写正确的是 ( )
A.硝酸银溶液的电解反应:4Ag++4OH-![]() 4Ag+O2↑+2H2O
4Ag+O2↑+2H2O
B.氯化镁溶液的电解反应:Mg2++2Cl-![]() Mg+Cl 2↑
Mg+Cl 2↑
C.稀硫酸与醋酸钠的反应:H++CH3COO-=CH3COOH
D.苯酚溶液与氢氧化钠溶液的反应:H++OH-=H2O
5.用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4 溶液做电解液,电解一段时间后,若阳极质量减少了x g,则下列说法中正确的是 ( )
A.阴极质量增加x g B.阴极质量增加b g,b<x
C.电解液质量增加x g D.阴极质量增加a g,a>x
6.H2在Cl2中燃烧时呈苍白色火焰并放出热量。反应过程中,破坏1molH2中的化学键消耗的能量为Q1 kJ,破坏1molCl2中的化学键消耗的能量为Q2 kJ,形成1molHCl中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是 ( )
A.Q1+Q2<Q3 B.Q1+Q2=Q3 C.Q1+Q2<2Q3 D.Q1+Q2>2Q3
07.下列说法中,正确的是 ( )
A.吸热反应在常温下一定很难发生
B.放热反应在常温下都很容易发生
C.吸热反应发生过程中需要不断从外界获得能量
D.需要加热才能发生的反应一定是吸热反应
8.下列方法中,不能加快铁和稀硫酸反应速率的是 ( )
A.加入少量CuCl2 B.加入少量ZnCl2
C.用铁粉代替铁片 D.用含少量碳的铁代替纯铁
9.有四种金属X、Y、Z、Q,它们的硝酸盐的化学式分别为XNO3、Y(NO3)2、ZNO3、Q(NO3)3。把各金属单质分别浸入0.1mol/L的其他三种硝酸盐的溶液中,可观察到:①Y可跟所有溶液反应;②X仅跟ZNO3溶液反应。由此可以判断这四种金属还原性的大小次序是 ( )
A.Z<X<Y<Q B.Q<Z<X<Y C.Z>X>Q>Y D.Z<X<Q<Y
10.工业上冶炼下列金属,采用电解法的是 ( )
A.银 B.锌 C.铝 D.铁
11.用石墨电极电解下列溶液,一段时间后,加入一定量的另一种物质(括号中),可以使电解后的溶液恢复至与原溶液完全相同的是 ( )
A.硫酸铜(氢氧化铜) B.硫酸钠(硫酸钠)
C.氯化镁(氯化氢) D.氯化铁(氯化铁)
12.下列表示有机物的名称中,可能正确的是 ( )
A.2-乙基戊烷 B.1,2,4-三甲苯
C.3-乙基丁烷 D.4,5-二甲基-3-乙基己烷
13.三位科学家因发现导电塑料荣获2000年诺贝尔化学奖。导电塑料的结构可表示为![]()
![]() [
CH=CH ]n,它的单体是
( )
[
CH=CH ]n,它的单体是
( )
A.乙烯 B.1,3—丁二烯 C.乙炔 D.乙烷
14.化学式为C8H8O2的芳香族化合物中,属于由脂肪酸所形成的酯类物质最多有 ( )
A.3种 B.4种 C.5种 D.6种
15.分别燃烧等物质的量的X、Y两种有机物,只生成等质量的CO2和等质量的H2O,现有下列结论:①X、Y一定互为同分异构;②X、Y的最简式一定相同。下列判断正确的是 ( )
A.只有①正确 B.①、②都正确
C.只有②正确 D.①、②都错误
16.有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有 ( )
A. 4种 B. 8种 C. 12种 D. 16种
17.下列除去括号内杂质的有关操作方法不正确的是 ( )
A.淀粉溶液(葡萄糖):渗析 B.蛋白质溶液(硫酸钠):过滤
C.苯(苯酚):加NaOH溶液,分液 D.肥皂液(甘油):加食盐搅拌、盐析、过滤
18.下列关于淀粉和纤维素的叙述中,不正确的是 ( )
A.它们都是混合物 B.它们都是天然高分子化合物
C.它们是同分异构体 D.它们水解的最终产物都是葡萄糖
19.在101kPa,500℃时,10mL某气态烃在80mL氧气中充分燃烧,得到85mL混合气体(气体体积均在相同条件下测定),则该气态烃可能是 ( )
A.丙烷 B.乙烷 C.乙烯 D.乙炔
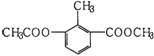 20.某有机物的结构简式如右下图所示,下列关于该物质的叙述错误的是 ( )
20.某有机物的结构简式如右下图所示,下列关于该物质的叙述错误的是 ( )
A.一氯代物有5种
B.一个分子中含有12个H原子
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol
21.1mol某有机物最多能与1molHCl完全加成,加成所得产物最多可与4molCl2发生取代反应,则该有机物的结构简式可能是 ( )
A.CH≡CH B.CH≡C-CH3
C.CH2=CH-CH=CH2 D.CH2=CH-Cl
22.下列对于苯、硝基苯、二甲苯的说法正确的是 ( )
A.苯、二甲苯、硝基苯均为芳香烃
B.苯、二甲苯、硝基苯均为苯的同系物
C.苯、二甲苯、硝基苯均能发生硝化反应(取代反应)
D.苯、二甲苯、硝基苯均能使酸性高锰酸钾溶液褪色
23.由溴乙烷制取乙二醇,依次发生反应的类型是 ( )
A.取代、加成、水解 B.消去、加成、取代
C.水解、消去、加成 D.消去、水解、取代
二.填空题(包括5题,共54分)
24.(共8分,各4分)
⑴已知下列两个热化学方程式:
C(s,石墨)+O2(g)= CO2(g) ΔH=-393.5 kJ/mol
![]() ΔH=-283.0 kJ/mol
ΔH=-283.0 kJ/mol
写出石墨在氧气中不完全燃烧生成一氧化碳的热化学方程式: __ 。
⑵在19.6℃时,使40.0mL 2.20mol/L的氢氧化钾溶液与40.0mL 2.00mol/L的盐酸混合,测得混合液的最高温度为33.2℃。假设以上溶液的密度都是1.00g/mL,比热容都是4.18J/(g·℃)。写出氢氧化钾溶液跟稀盐酸反应的热化学方程式: ____________ 。
25.(共10分,各2分)
写出下列原电池反应或电解反应的电极反应式并回答有关问题。
⑴铜在空气中生成铜绿[Cu2(OH)2CO3] :
①负极电极反应式: ;
②正极电极反应式(有OH-、CO32-生成): 。
⑵用铁作电极,电解氯化钠溶液:
①阴极电极反应式: ;
②阳极电极反应式: 。
③氯化钠在电解中的作用是: _________________ 。
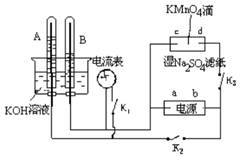 |
26.(共14分,各2分)
如右图装置,A、B中的电极为多孔的惰性电极;c、d为夹在
湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B
充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,合闭
K2、K3,通直流电。则:
⑴在湿润有Na2SO4溶液的滤纸条上的中心所滴加的KMnO4液
滴,有什么现象: _________ 。
⑵标出电源的正、负极,a为 极,b为 极。
⑶若电解一段时间后,A、B中均有气体吸附在电极上。此时
切断K2、K3,合闭K1,则电流表的指针是否发生移动 (填“是”或“否”) 。
⑷若⑶中的电流表指针发生移动,请说明理由并写出电极反应式;若指针不移动,也请说明理由。理由是: ___________________ ;
A电极的电极反应方程式: ,
B电极的电极反应方程式: 。
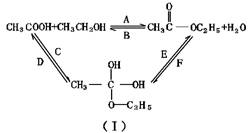 |
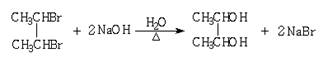
27.(共6分,各3分)
乙酸跟乙醇在浓硫酸存在并加热条件下发生酯化反应
(反应A),其逆反应是水解反应(反应B),反应
可能经历了生成中间体(Ⅰ)这一步。
⑴如果将以上反应按照加成、消去、取代反应分类,则A~F 这6个反应中(将字母填入下列空格里),属于消去反应的是 。
⑵如果①使原料CH3CH2OH中的氧用18O进行标记,②使原料CH3COOH中羰基或羟基的氧用 18O进行标记,则下列关于生成物是否含有 18O的分析中正确的是 。
A.两种情况下所生成的乙酸乙酯中都含有 18O
B.第②种情况所生成的乙酸乙酯中不含有 18O
C.第①种情况所生成的乙酸乙酯中不含有 18O
D.两种情况下所生成的水中都不含有 18O
28.(共16分。⑹4分,其它每空各2分)
烯烃的复分解反应也称之为烯烃的歧化反应,反应机理可表示为:

已知C是石油化学工业最重要的基础原料,I的分子式为C8H14O4,试根据下图关系,回答问题:
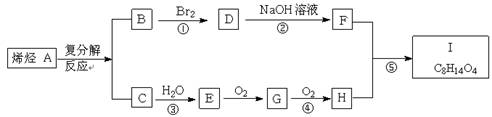
⑴C在石油化学工业中主要用于直接制取一种重要的塑料,
该塑料的化学名称是 。
⑵E是我们比较熟悉的一种液态有机物,属于新的可再生能源。已知E的标准燃烧热(ΔH)为-Q kJ/mol,写出E在空气中完全燃烧的热化学方程式: ____________ 。
⑶反应①、②、③、④、⑤中,属于加成反应的有 _____ 。
⑷写出下列化合物的结构简式:
A. ___________ , I. ___ 。
⑸写出反应②的化学方程式: __________ 。
⑹F有多种属于二元醇的同分异构体,除下列三种外,
![]() ,
,
写出其它同分异构体(一个碳原子上不能连接两个羟基)的结构简式:
____________ 。
参考答案
一、选择题(本题包括23小题。每小题2分,共46分。每小题只有 1 个选项符合题意)
| 1 | D | 2 | B | 3 | B | 4 | C | 5 | B |
| 6 | C | 7 | C | 8 | B | 9 | D | 10 | C |
| 11 | C | 12 | B | 13 | A | 14 | C | 15 | D |
| 16 | D | 17 | B | 18 | C | 19 | D | 20 | A |
| 21 | D | 22 | C | 23 | B | 选择题得分 | |||
二、填空题(包括5题,共54分)
24.(共8分,各4分)
![]() ΔH=-110.5 kJ/mol
ΔH=-110.5 kJ/mol
⑴ 。
⑵ KOH(aq)+HCl(aq)=KCl(aq)+H2O(l) ΔH=-56.9 kJ•mol-1 。
25.(共10分,各2分)
⑴① Cu-2e-=Cu2+ 或2Cu-4e-=2Cu2+。
②H2O+CO2+O2+4e-=2OH-+CO32-。
⑵①2H++2e-=H2↑。
②Fe-2e-=Fe2+。
③作电解质,(降低溶液电阻)增大电流,加快电解速率。
26.(共14分,各2分)
⑴紫色溶液向d电极方向缓慢移动。
⑵ a为负极,b为正极。 ⑶是。
⑷H2、O2、KOH溶液以及铂电极和导线构成H2、O2燃料原电池;
A电极反应式: O2+2H2O+4e-=4OH-,
B电极反应式: H2+2OH--2e-=2H2O。
27.(共6分,各3分)
⑴D E。 ⑵A。
28.(共16分。⑹4分,其它每空各2分)
⑴聚乙烯。
⑵C2H6O (l)+3O2(g) = 2CO2(g)+3H2O(l) ;ΔH=-Q kJ·mol-1。
⑶① ③。
CH3CH=CH2
⑷A. , I. 。
 |
⑸ 。
 |
⑹ 。