高二理科化学上学期期末考试试卷
时间100分钟 总分100分 命题人:袁廷新 2008-1-23
第I卷 选择题
(本题包括18小题,每小题3分,共54分,每小题只有一个正确答案)
1.20世纪末,由中国学者和美国科学家共同合成了世界上最大的碳氢分子,其一个分子由1334个碳原子和1146个氢原子构成.关于此物质,则其分子中含有的碳碳三键最多有
A.281 B.148 C.149 D.150
2.有6种物质:①甲烷;②苯;③聚乙烯;④苯乙烯;⑤丁炔;⑥邻二甲苯。既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是
A.③④ B.④⑤ C. ④⑤⑥ D. ③④⑤
3.4-甲基-2-乙基-1-戊烯经催化加成所得产物名称为
A.4-甲基-2-乙基戊烷 B.2、5-二甲基戊烷
C.2、4-二甲基己烷 D.2-乙基-4-甲基戊烷
4.在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(D)= 1 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(B)= 0.3 mol/(L·s)
5.燃烧lg乙炔生成二氧化碳和液态水,放出热量50kJ,则这一反应的热化学反应方程式为
A.C2H2(g)+5/202(g) 2CO2(g)+H2O(l);△H=-1300kJ
B.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=+50kJ/mol
C.2C2H2+5O2 4CO2+2H2O;
△H=-2600kJ
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=+2600kJ/mol
6.下列说法不正确的是
A.原电池负极被氧化
B.任何化学反应都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
7.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处.把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.小于40.0mL B.为40.0 mL C.大于40.0mL D.为10.0mL
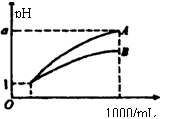 8.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,
8.pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,
其pH与溶液体积(V)的关系如图示,下列说法不正确的是
A.若1<a<4,则A、B都是弱酸
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.A、B两种酸溶液的物质的量浓度一定相等
 9. 已知Mg(OH)2溶度积KSP==5×10-13
mol3·L-3,则其饱和溶
9. 已知Mg(OH)2溶度积KSP==5×10-13
mol3·L-3,则其饱和溶
液的pH为
A 3.48 B 3.78 C 10.52 D 10.00
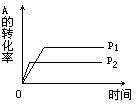
10. 现有可逆反应A(g)+2B(g)![]() nC(g);△H<0,在相同
nC(g);△H<0,在相同
温度、不同压强时,A的转化率跟反应时间(t)的关系如图,
其中结论正确的是
A.p1>p2,n>3 B.p1<p2,n>3
 C.p1<p2,n<3 D.p1>p2,n=3
C.p1<p2,n<3 D.p1>p2,n=3
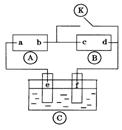
11.下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
后,使c、d两点短路.下列叙述正确的是
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
12.在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
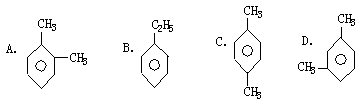
13.相对分子质量小于142的烷烃中,与Cl2发生取代反应时,生成的一氯取代物只有一种的物质有
A.2种 B.3种 C.4种 D.5种
 |
14.某烃的分子式为
15.丙烯与某气态烯烃组成的混合气体完全燃烧时,所需氧气的体积是混合气体体积的3倍(相同条件),则该气态烃是
A.C4H8 B.C3H4 C.C2H4 D.CH4
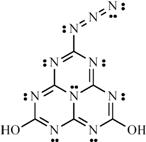 16.1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示。老人为什么画这个结构式?它是生命的前物质?它能合成吗?它有什么性质?不得而知。也许这是永远无法解开的谜;也许你有朝一日能解开它。某同学对此结构及性质有如下的推测,你认为不正确的是
16.1994年伟大的化学家鲍林(Linus Pauling)教授谢世时,留给后人很多谜团,其中一个结构式如图所示。老人为什么画这个结构式?它是生命的前物质?它能合成吗?它有什么性质?不得而知。也许这是永远无法解开的谜;也许你有朝一日能解开它。某同学对此结构及性质有如下的推测,你认为不正确的是
A.它的分子式是C6N10H2O2
B.因其含氮量高,有可能作炸药
C.它可以与别的物质发生加成反应
D.该物质最多可以有18个原子处于同一个平面上
17.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
 A.
B.
A.
B.
 C.
D.
C.
D.
18、在给定的四种溶液中,加入以下各种离子,各离子一定能在该溶液中大量共存的有
A.滴加石蕊试液显红色的溶液
Fe2+ 、NH![]() 、Cl- 、NO
、Cl- 、NO![]()
B.pH值为1的溶液
Cu2+、Na+ 、Mg2+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液 K+ 、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
第Ⅱ卷 非选择题
(本题包括5小题,共46分)
19.(6分)有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、NO3-、C1-中的一种或几种。取该溶液进行以下实验:
(1) 溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2) 取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3) 取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4) 将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5) 另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色。
根据上述实验事实确定:
在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
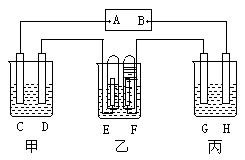 20、(12分)有甲、乙、丙三个串连的电解槽,如下图所示连接。其中电极C、D、E、F都是Pt片,电解G是Fe片,H是Cu片。甲池中电解液为饱和食盐水;乙池中电解液为稀硫酸;丙池中电解液为硫酸铜。当接通电路一段时间后,现象如图所示。
20、(12分)有甲、乙、丙三个串连的电解槽,如下图所示连接。其中电极C、D、E、F都是Pt片,电解G是Fe片,H是Cu片。甲池中电解液为饱和食盐水;乙池中电解液为稀硫酸;丙池中电解液为硫酸铜。当接通电路一段时间后,现象如图所示。
(1)A是 极, C是 极,D是 极。
(2)若向甲池中加入少许酚酞试液, 极附
近显红色;若向甲池中加入少许淀粉碘化钾溶液,
极附近显蓝色。
(3)G极上现象是 ,H极上的现象
是 ,丙池是 装置。
(4)E极上发生 反应,电极反应式是 ;F极上发生 反应,电极反应式是 。
21.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
22.( 8分)烷基取代苯![]() R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成![]() COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到![]() COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为![]() COOH的异构体共有7种,其中的3种是
COOH的异构体共有7种,其中的3种是![]() CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,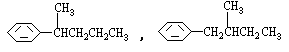
请写出其他4种的结构简式:_______________________________________
23.(12分)A、B、C、D均为短周期元素,A、B可形成两种液态化合物B2A2、B2A, A与D可形成气态化合物DA、![]() ;A、B、D可形成一种化学组成为
;A、B、D可形成一种化学组成为![]() 的离子化合物,其为强酸弱碱盐;B与D可形成气体X,B与C可形成气体Y,已知X分子与
的离子化合物,其为强酸弱碱盐;B与D可形成气体X,B与C可形成气体Y,已知X分子与![]() 分子中的电子数相等,Y分子中的电子数与B2A2分子中的电子数相等,X与Y相遇会产生大量白烟。请回答:
分子中的电子数相等,Y分子中的电子数与B2A2分子中的电子数相等,X与Y相遇会产生大量白烟。请回答:
(1)写出X与Y反应所得产物的电子式 。
(2)写出下列反应的化学方程式:
![]() +…
。
+…
。
(3)![]() 的化学式为____________,其水溶液与氢氧化钠溶液混合加热恰好反应的离子方程式为_____________________________________________。反应混合物中各种离子浓度的大小关系为
。
的化学式为____________,其水溶液与氢氧化钠溶液混合加热恰好反应的离子方程式为_____________________________________________。反应混合物中各种离子浓度的大小关系为
。
(4)已知液态X与![]() 相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则液态X中的电离方程式为_______________________________________。
相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则液态X中的电离方程式为_______________________________________。
![]()

理科化学答 题 卡
第I卷 选择题(本题包括18小题,每小题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷 非选择题(本题包括5小题,共46分)
19.(共6分)
肯定存在的离子是 _________ ,
肯定不存在的离子是 ___________________ ,
不能确定是否存在的离子是 ___ 。
20.(共12分)
(1)A是 极, C是 极,D是 极。
(2) , 。
(3)G极上现象是 ,H极上的现象是 ,丙池是 装置。
(4)E极上发生 反应,电极反应式是 ;
F极上发生 反应,电极反应式是 。
21.(共8分)
(1)K = 。
(2)该反应为 反应(选填吸热、放热)。
(3)依据是 (多选扣分)。
(4)温度为 ℃。
22.(共8分)
23.(共12分)
(1)电子式 。
(2)写出下列反应的化学方程式: 。
(3)![]() 的化学式为______ _ _,离子方程式为_______________________。
的化学式为______ _ _,离子方程式为_______________________。
各种离子浓度大小关系 。
(4)液态X中的电离方程式为_________________________________。
理科化学参考答案
一、选择题(本题包括18小题,每小题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | B | C | D | A | B | C | D | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | D | C | C | D | D | C | B |
第Ⅱ卷 非选择题部分(本题共包括5小题,共46分)
19.(6分)Fe3+、NO3-、Al3+、SO42-;
HCO3-、Ba2+、Fe2+;
NH4+、C1-
20.(12分)(1)A是 负 极,C是 阴 极,D是 阳 极。
(2)若向甲池中加入少许酚酞试液, C 极附近显红色;若向甲池中加入少许淀粉碘化钾溶液, D 极附近显蓝色。
(3)G极上现象是 有红色固体析出 ,H极上的现象是 铜棒溶解变细 ,丙池是 电镀 装置。
(4)E极上发生 还原 反应,电极反应式是 2H++2e-=H2↑ ;F极上发生 氧化 反应,电极反应式是 4OH--4e-=2H2O+O2↑ 。
21.(8分)
(1)![]() ;(2)吸热;(3)b、c; (4)830
;(2)吸热;(3)b、c; (4)830
22.(8分)
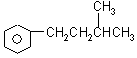 、
、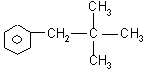 、
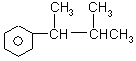
、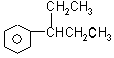 、
、
23.(12分,每空2分)(1)![]()
(2)3Cl2+8NH3=N2+6NH4Cl 或3Cl2+2NH3=N2+6HCl
(3)NH4NO3;![]()
![]()
![]()
c(Na+)=c(NO3-)>c(NH4+)>c(OH-)>c(H+)
(4)![]()
![]()
![]()