高二理科化学上学期期末联考试卷
命题人:齐齐哈尔市实验中学 郝明欣 龙江一中 肖春会
可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 Al 27 Fe 56 Cu 64
Ⅰ卷 (选择题 共48分)
一 .选择题(本题包括6小题,每小题2分,共12分。每小题只有一个选项符合题意。)
1.能使水的电离平衡向右移动,且所得溶液呈碱性的是
A. 在水中加入Na2CO3固体 B. 在水中加入AlCl3固体
C. 在水中通入HCl气体 D. 将水加热至80℃
2.下列物质中,不能使酸性高锰酸钾溶液褪色的是
A.乙烯 B.丙炔 C.己烷 D.SO2
3.钢铁在潮湿的空气中会发生电化学腐蚀,以下说法正确的是
A.负极发生的反应为:Fe-2e-=Fe2+
B.正极发生的反应为:2H2O+O2+2e-=4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
4. 向2 ml 0.5 mol/L的FeCl3溶液中加入3ml 5 mol/L的KF溶液,发现FeCl3溶液渐渐褪至无色,再加入KI溶液和CCl4振荡后静置不见CCl4层有紫红色,则下列说法正确的是
A.Fe3+不与I-发生反应 B. Fe3+与F-结合生成不与I-反应的物质
C.F-使I-的还原性减弱 D. Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
5.在由水电离产生的H+浓度为 1×10-13mol·L-1 的溶液中,一定能大量共存的离子组是
① K+、Cl―、NO3―、S2― ② K+、Fe2+、I―、SO42― ③ Na+、Cl-、NO3-、SO42-
④ Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
6.两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L.下列各组混合烃中符合此条件的是
A.CH4 C2H2 B.CH4 C3H6 C.C2H2 C3H6 D.C2H4 C3H4
二.选择题(本题包括12小题,每小题3分,共36分。每小题只有一个选项符合题意。)
7. 由两种气态烃组成的混合气体0.1 mol,与过量的O2混合后完全燃烧,生成CO2 4.48L(标准状况)和2.7g H2O,则该烃的组成可能是
A. CH4 C2H4 B. C2H6 C2H2
C. CH4 C3H6 D. C3H6 C2H2
8. 既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有少量乙烯的最好试剂是
A. 过量的溴水 B. 过量的酸性高锰酸钾溶液
C. 过量的H2 D. 过量的Br2的四氯化碳溶液
9.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
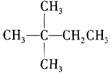
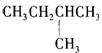 A.
B.
A.
B.
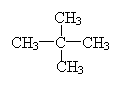 |
C. CH3CH2CH2CH2CH3 D.
10.下列有机分子中,所有的原子一定处于同一平面的是
A.CH2=CH-CH=CH2 B.CH2=CH-C≡CH
C.CH2 =CH-CH2-C≡CH D.CH2=CH-C=CH2
|
CH3
11. 下列几种液体分别与少量溴水混合振荡,静止后分为两层,上下层均为无色的是
A. 己烷 B. CCl4 C. NaOH溶液 D. 己烯
12. 常温时,以下4种溶液pH最小的是
A. 0.01mol ·L-1醋酸溶液
B. 0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积混合液
C. 0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积混合液
D. pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
13.用0.1mol·L-1 NaOH溶液滴定0.1mol·L-1 盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是
A.4 B.7.2 C.10 D.11.3
![]() 14.在一密闭容器,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
14.在一密闭容器,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a > b
15. 在一个容积恒定的容器中充入2 mol A和1 mol B发生反应:
![]() 2A (g)+ B(g)
xC(g) 达到平衡后C的体积分数为W%;若维持容器的体积和温度不变,按起始物质的量0.6 mol A、0.3 mol B和1.4 mol C充入容器,达到平衡后,C的体积分数仍为W%,则x值为
2A (g)+ B(g)
xC(g) 达到平衡后C的体积分数为W%;若维持容器的体积和温度不变,按起始物质的量0.6 mol A、0.3 mol B和1.4 mol C充入容器,达到平衡后,C的体积分数仍为W%,则x值为
A. 可能是2,也可能是3 B. 只能为2
C. 只能 为3 C.无法确定
16.在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A. c(Na+)=c(CH3COO-)+c(CH3COOH)
B. c(H+)=c(CH3COO-)+c(OH-)
C. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
17. 某气态烃A 100mL, 最多可与200mL氯化氢气体发生加成反应生成B,
1molB最多可与4mol氯气发生取代反应,则A为
A.CH2=CH-CH=CH2 B. CH2=CH2
C.CH3-C![]() CH
D.CH
CH
D.CH![]() CH
CH
18.将11.2g铁粉溶解在500 ml 稀硝酸中,完全溶解后,再加入6.4g铜粉,铜粉完全溶解且无气体产生,则原硝酸的物质的量浓度为
A. 1.2 mol/L B. 1.4 mol/L C. 1.6 mol/L D. 1.8 mol/L
Ⅱ卷 (非选择题 共52分)
三.(本题包括2小题,共16分)
19.(5分)化学电池在通讯、交通及生活中有着广泛的应用。如图装置由镁条、铝条和某种电解质溶液组成。
⑴若电解质溶液为稀硫酸,则原电池的负极反应为 ,正极上的现象为
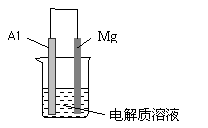 ⑵若电解质溶液为较浓的NaOH溶液,此装置能否构成原电池
(填“能”或“否”,若填“否”,则后面不需作答)。若能构成原电池,则外电路电子从 流向
⑵若电解质溶液为较浓的NaOH溶液,此装置能否构成原电池
(填“能”或“否”,若填“否”,则后面不需作答)。若能构成原电池,则外电路电子从 流向
 (填“Mg”或“Al”).当线路中有0.6 mol电子通过时,消耗负极材料的质量是 g。
(填“Mg”或“Al”).当线路中有0.6 mol电子通过时,消耗负极材料的质量是 g。
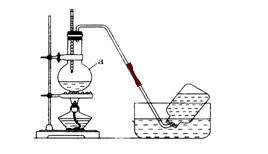
20.(11分)下图是某同学设计的
实验室用酒精和浓硫酸混合制乙烯
的实验装置图,回答下列问题
⑴ 指出装置中存在的明显错误是
⑵在反应容器a中发生的化学反应方程式是 ;
反应中浓硫酸的作用是
⑶加热混合液时,应使液体温度迅速升到170℃,原因是
⑷在进行乙烯性质实验前,先将产生的气体通过质量分数为10%的NaOH溶液,此项操作的目的是
⑸将用NaOH溶液洗涤后的气体分别通过溴的四氯化碳溶液和酸性高锰酸钾溶液中,溶液颜色均可褪去,使其褪色的反应类型 ,其中使溴的四氯化碳溶液褪色的化学反应方程式为
四.(本题包括5小题,共31分)
21.(4分)有MgCl2和Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到沉淀量与加入的NaOH溶液的体积关系如图所示
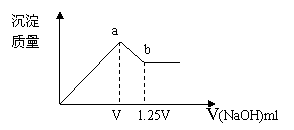
⑴写出由a点到b点时反应的离子方程式
⑵溶液中C(Cl-)与C(SO42-)之比为
22.(12分)混合物A由KAl(SO4)2 、Al2O3和Fe3O4组成,在一定条件下可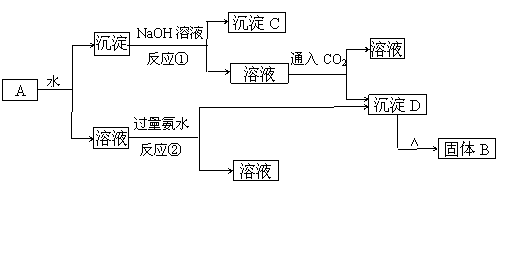 实现如下图所示的物质之间的转化
实现如下图所示的物质之间的转化
⑴反应①的离子方程式
反应②的离子方程式
⑵ 将沉淀C加入过量的稀盐酸中充分反应,简述所得溶液中Fe3+的检验方法 有关检验的离子方程式
⑶ 利用⑵中的溶液制取FeCl3∙6H2O晶体,设计流程如下:
![]()
![]() 溶液 FeCl3溶液 FeCl3∙6H2O晶体
溶液 FeCl3溶液 FeCl3∙6H2O晶体
① 步骤Ⅰ中通入Cl2的作用(用化学方程式说明)
② 步骤Ⅱ中从FeCl3溶液中得到FeCl3∙6H2O晶体的主要操作包括
③该流程中需要保持盐酸过量,主要原因是(结合离子方程式简要说明)
![]() 23.(4分)可逆反应: aA(g) + bB (g) cC(g)+ dD(g) 试根据图回答问题
23.(4分)可逆反应: aA(g) + bB (g) cC(g)+ dD(g) 试根据图回答问题
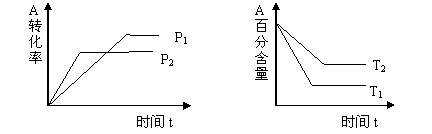

⑴ 压强P1 P2 (填“<”“>”或“=”)
⑵ a + b c+ d (填“<”“>”或“=”)
⑶ 温度T1 T2 (填“<”“>”或“=”)
⑷ 该反应的正反应为 (填“吸热”或“放热”)
24.(7分)⑴通常烷烃由相应的烯烃经催化加氢得到,但是分子式为C5H12的烷烃A却不能由任何C5H10的烯烃加氢得到,而A的一种同分异构体B,可由三种相应的烯烃催化加氢得到。则A和B的结构简式分别为 、
⑵某无色透明溶液,跟金属铝反应放出H2,在原溶液中可能存在下列离子:Mg2+、Cu2+、Ba2+、Ag+、H+、SO42-、SO32-、HCO3-、OH-、NO3-。当金属铝与其作用生成AlO2-时,在原溶液中一定大量存在的离子是 ,
可能还大量存在 离子。
25.(4分)若使1 mol CH4与Cl2在一定条件下发生取代反应,假设生成的四种氯代物的物质的量相同,需Cl2物质的量为 mol ;当恢复至室温时,生成气体的总物质的量为 mol
五.(5分)
26.有两种烃的蒸气,B对A的相对密度为3,它们等物质的量混合后完全燃烧,所消耗的O2为混合气体的5倍(同温同压下体积比),两烃分别燃烧得到生成物的质量比均为m(CO2)∶m(H2O)= 44∶9,求这两种烃的分子式
高二化学答题卡
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 答案 |
二、
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、
19. ⑴ ,
⑵ , ,
20. ⑴
⑵ ,
⑶
⑷
⑸
四、
21. ⑴
⑵
22. ⑴①
②
⑵
⑶①
②
③
23. ⑴ ⑵ ⑶ ⑷
24. ⑴
⑵ ,
25. ,
五、 26.
高二化学试卷参考答案
一、(每小题2分,共12分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 答案 | A | C | A | B | B | D |
二、(每小题3分,共36分)
| 题号 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | A | C | B | D | A | C | C | A | D | D | C |
三、
19. (5分)
⑴ Mg - 2e- = Mg2+ 1分 有气泡产生 1分
⑵ 能 1分; Al、Mg 1分; 5.4g 1分
20.(11分)
⑴ 温度计下端的水银球未插入液面以下 2 分
|
|
⑶ 减少副反应发生(或减少副产物) 1分
⑷ 除去乙烯中混有的SO2、CO2、乙醇等杂质 1分
⑸ 前者为加成反应,后者为氧化反应 2分
CH2=CH2 + Br2→ CH2BrCH2Br 2分
21. 各2 分
⑴ Al(OH)3+ OH- = AlO2- + 2H2O
⑵ 2∶3
22.(12分)
⑴ Al2O3 + 2OH- = 2AlO2-+ H2O 2分
Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+ 2分
⑵ 取少量溶液,滴几滴KSCN溶液,观察溶液是否变红 1分
Fe3++ 3SCN- = Fe(SCN)3 1分
⑶ 各2分
① 2FeCl2 + Cl2 = 2FeCl3
② 加热浓缩、冷却结晶、过滤
![]() ③ Fe3++
3H2O
Fe(OH)3+ 3H+ ,过量的盐酸可抑制Fe3+
的水解
③ Fe3++
3H2O
Fe(OH)3+ 3H+ ,过量的盐酸可抑制Fe3+
的水解
23.(4分)
各1分 ⑴ < ⑵ < ⑶ > ⑷ 吸热
|
|
|
⑵ Ba2+、OH-, 2分 NO3- 1分
25.(4分) 各2分 2.5 2.75
五、26.(5分)
解:两烃燃烧后:n(CO2)∶n(H2O) = ![]() ∶
∶![]() = 2∶1
= 2∶1
烃分子中:n(C) ∶n(H) = 1∶1 ……………… 1分
根据 M(B) = 3M(A)
设烃A分子式为CnHn ,烃B分子式为C3nH3n
CnHn ~(n+![]() )O2
, C3nH3n ~(3n+
)O2
, C3nH3n ~(3n+![]() )O2
)O2
则(n+![]() ) + (3n+
) + (3n+![]() ) = 2×5
) = 2×5
n =2 ………………………………… 2分
∴ 烃A的分子式为C2H2 ………………… 1分
烃B的分子式为C6H6 ………………… 1分