高二理科化学秋季学期期中考试试题
化 学 试 题
(总分:120分 考试时间:120分钟)
命题教师:苏 亚 审题教师:陈爱红
一、选择题(下列各题只有一个选项符合题意,每题3分,共57分)
1.下列反应条件中,通常能缩短反应所需时间,而不能改变化学反应进行程度的是
A.浓度 B.压强 C.温度 D.催化剂
2.在一个1L的密闭容器中,发生如下反应:3A+B=2C (A、B、C均为气体),若最初加入的A、B都是2mol,A的平均反应速率为0.12mol/(L·s),则10s后容器中B的物质的量是
A.2.4mol B.1.6mol C.0.4mol D.0.8mol
![]() 3.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A的浓度为0.5mol/L;当恒温下将密闭容器的容积扩大到以前的两倍并再次达到平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是
3.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A的浓度为0.5mol/L;当恒温下将密闭容器的容积扩大到以前的两倍并再次达到平衡时,测得A的浓度为0.3mol/L。则下列叙述正确的是
A.平衡向正反应方向移动 B.x+y>z
C.B的转化率提高 D.C的物质的量分数增加
![]() 4.在一定条件下,反应CO+NO2 CO2+NO 达到平衡后,降低温度,混合气体的颜色变浅,下列判断正确的是
4.在一定条件下,反应CO+NO2 CO2+NO 达到平衡后,降低温度,混合气体的颜色变浅,下列判断正确的是
A.正反应为吸热反应 B.CO的浓度增大
C.正反应为放热反应 D.NO2的质量增大
5.CH3COOH的下列性质中,能证明它是弱电解质的是
A.10mL1mol/LCH3COOH恰好与10mL1mol/LNaOH溶液完全反应
B.0.1mol/LCH3COOH溶液的pH约为2.9
C.CH3COOH在溶液中能电离出H+和CH3COO-
D.CH3COOH溶液能溶解石灰石
6.某种溶质的溶液的pH=2,向该溶液中加水到体积变为原来溶液体积的10倍,所得溶液的pH在2——3之间,则溶液中的溶质可能是①强酸②弱酸③强酸弱碱盐④强碱弱酸盐
A.②④ B.②③ C.③④ D.①②
![]() 7.氨水中有下列平衡:NH3•H2O NH4++OH-,当其它条件不变时,改变下列条件,可使c(NH4+)减小的是
7.氨水中有下列平衡:NH3•H2O NH4++OH-,当其它条件不变时,改变下列条件,可使c(NH4+)减小的是
A.加入NaOH固体 B.通入HCl气体 C.加入NH4Cl固体 D.加入同浓度氨水
![]() 8.某温度下,反应N2O4(g) 2NO2(g)(正反应为吸热反应)在密闭容器中达到平衡,下列说法不正确的是
8.某温度下,反应N2O4(g) 2NO2(g)(正反应为吸热反应)在密闭容器中达到平衡,下列说法不正确的是
A.加压(体积变小),将使正逆反应速率均加快
B.保持体积不变,加入少许NO2的瞬间将使正反应速率减小
C.保持体积不变,加入少许N2O4,再达平衡时,颜色变深
D.保持体积不变,升高温度,再达平衡时,颜色变深
9.下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅 B.H2、I2、HI平衡混合气加压后颜色变深
C.工业上将SO2氧化成SO3时,采用过量空气 D.合成氨常采用20~50M Pa的压强
10.下列哪一个选项是通过提高反应物的能量来使活化分子的百分数增大,从而达到化学反应速率加快的目的
A.增大某一组分的浓度 B.增大体系的压强
C.使用合适的催化剂 D.升高体系的温度
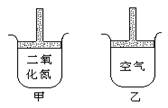 11.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮(有关可逆反应见第8题)和空气,现分别进行下列两个实验:
11.常温常压下在带有可移动活塞的甲、乙容器(如图)里分别充有二氧化氮(有关可逆反应见第8题)和空气,现分别进行下列两个实验:
①将两容器都置于冰水中冷却
②在活塞上都加50g的砝码
在以上两情况下,甲和乙容器的体积大小的比较
正确的是
A.①甲>乙②甲>乙 B.①甲>乙②甲<乙
C.①甲<乙②甲<乙 D.①甲<乙②甲>乙
![]() 12.水的电离过程为H2O H++OH-,在不同温度下其离子积为:25℃时,Kw=1.0×10-14 ,35℃时,Kw=2.1×10-14,则下列叙述正确的是
12.水的电离过程为H2O H++OH-,在不同温度下其离子积为:25℃时,Kw=1.0×10-14 ,35℃时,Kw=2.1×10-14,则下列叙述正确的是
A.c(H+)随温度的升高而降低 B.在35℃时,c(H+)>c(OH-)
C.水的电离过程是一个吸热过程 D.水的电离程度是25℃大
13.下列各组离子中,能大量共存的是
A.K+、Fe3+、SCN- B.Al3+、SO42-、HCO3-
C.Mg2+、CH3COO-、Cl- D.Fe2+、H+、NO3-
![]() 14.反应2A(g) 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
14.反应2A(g) 2B(g)+E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减小E的浓度 D.降温
15. 温度每升高10℃,某化学反应的速率增加为原来的3倍。当温度升高30℃时,该反应的速率为原来的倍数是
A.9 B.27 C.30 D.90
16.在一个密闭容器中充入1molCO2和3molH2,在8500C时,气体混合物达到平衡:
![]() CO2+H2 CO+H2O。已知达到平衡时生成0.75molCO,那么当H2改为9mol,在上述条件下平衡时生成CO与H2O的物质的量之和可能为
CO2+H2 CO+H2O。已知达到平衡时生成0.75molCO,那么当H2改为9mol,在上述条件下平衡时生成CO与H2O的物质的量之和可能为
A.1.2mol B.1.5mol C.1.8mol D.2.5mol
![]() 17.在体积相同的两密闭容器A和B中,分别充入amol和bmolHI(a>b),发生反应达平衡:2HI(g) I2(g)+H2(g)。下列说法正确的是
17.在体积相同的两密闭容器A和B中,分别充入amol和bmolHI(a>b),发生反应达平衡:2HI(g) I2(g)+H2(g)。下列说法正确的是
A.从反应开始到平衡所需时间t(A)>t(B) B.平衡时I2的浓度c(A)=c(B)
C.平衡时,I2在混合气体中的体积分数ω(A)>ω(B) D.HI的分解率:α(A)=α(B)
![]() 18.可逆反应mA(s)+nB(g) pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下
18.可逆反应mA(s)+nB(g) pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下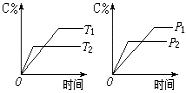 列叙述中正确的是
列叙述中正确的是
A.平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后,增大A的量,有利于平衡向正反应方向移动
D.一定有下列关系:m+n<p+q
19.在20mL0.1mol/LCH3COONa溶液中逐渐滴入0.1mol/L稀硫酸至溶液刚好呈中性,下列叙述正确的是
A.CH3COONa恰好与硫酸反应 B.反应后溶液体积为40mL
C.反应后溶液中有下列关系:c(CH3COO-)+c(SO42-)+c(OH-)=c(Na+)+c(H+)
D.反应后溶液中有下列关系:c(OH-)=c(H+)
宜昌市一中2007年秋季学期高二理科期中考试
化 学 试 题
选择题答案栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
二、填空简答题(本题包括7小题,共50分)
20.(10分)按要求将不同条件下对FeCl3水解平衡的影响填入下表(填相应字母)
A——向正反应方向移动,B——向逆反应方向移动,C——变大,D——变小
| 条 件 | 平衡移动方向 | pH变化 | Fe3+水解程度的变化 |
| 升 温 | |||
| 通 HCl | |||
| 加 H2O | |||
| 加FeCl3 | |||
| 加 CuO |
![]() 21.(4分)一定条件下,可逆反应A2+B2 2C在一个恒容密闭容器中达到平衡时,测得c(A2)=0.2mol/L、c(B2)=0.5mol/L、c(C)=2.0mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、dmol/L。请确定:
21.(4分)一定条件下,可逆反应A2+B2 2C在一个恒容密闭容器中达到平衡时,测得c(A2)=0.2mol/L、c(B2)=0.5mol/L、c(C)=2.0mol/L。若A2、B2、C的起始浓度分别为amol/L、bmol/L、dmol/L。请确定:
⑴a、b应满足的关系式为a=________________;
⑵b的取值范围为______ ________。
22.(10分)在容积为V升的容器中加入一定量的A和B,加热发生如下反应:
![]() mA(g)+nB(g) pC(g)+qD(g),经t秒后达到平衡,测得平衡混合气中A为x摩,B为y摩,C为z摩。
mA(g)+nB(g) pC(g)+qD(g),经t秒后达到平衡,测得平衡混合气中A为x摩,B为y摩,C为z摩。
⑴反应前加入容器中A的物质的量为 mol,B的物质的量为 mol;
⑵t秒内以B的浓度变化表示的反应的平均速率为 ;
⑶若减小容器的体积会减少D的物质的量,则m、n、p、q的关系是 ;
⑷当A、B充入容器后,加热到反应发生立即停止加热,反应仍能继续进行,达到平衡时,若降低温度,则A的转化率会 。
23.(4分)将pH=3的硫酸溶液和pH=10的氢氧化钠溶液相混合
⑴若要使混合液的pH为7,则硫酸和氢氧化钠溶液的体积比为 ;
⑵若将两溶液等体积混合,则混合液中c(H+)为 。
24.(8分)今有①CH3COOH、②HCl、③H2SO4 三种溶液,用序号回答下列问题
⑴当它们pH相同时,其物质的量浓度由大到小排列是 ;
⑵当它们的物质的量浓度相同时,其c(H+)由大到小排列是 ;
⑶中和等量的烧碱溶液,需同浓度的三种酸溶液的体积关系为 ;
⑷体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,所需烧碱溶液的体积关系为 。
25.(10分)NaHCO3在水溶液中,HCO3-的电离程度小于HCO3-的水解程度。回答下列有关问题:
⑴H2CO3的电离方程式为 ;
⑵NaHCO3溶液显碱性,原因是(用离子方程式表示) ;
⑶在该溶液中,c(Na+)、c(H+)、c(HCO3-)、c(OH-)的大小关系为 ;
⑷根据电荷守恒原理,该溶液中离子浓度关系有:c(Na+)+c(H+)= ;
⑸根据物料守恒原理,该溶液中离子浓度关系有:c(Na+)= 。
26.(4分)五氧化二氮是一种白色固体,熔点30℃,升温时易液化和气化,并发生分解反应:
![]()
![]() N2O5(g) N2O3(g)+O2(g)
N2O3(g) N2O(g)+O2(g)
N2O5(g) N2O3(g)+O2(g)
N2O3(g) N2O(g)+O2(g)
在0.5升的密闭容器中,将2.5摩尔N2O5加热气化,并按上式分解,当在某温度下达到化学平衡时,氧气的平衡浓度为4.4mol/L,N2O3的平衡浓度为1.6mol/L
⑴N2O5的分解率是 ; ⑵N2O的平衡浓度是 。
三、计算题(本题包括2小题,共13分)
![]() 27.(7分)将3molN2和4molH2在适宜条件下按下式反应:N2+3H2 2NH3,在某一温度下达到化学平衡状态。试回答:
27.(7分)将3molN2和4molH2在适宜条件下按下式反应:N2+3H2 2NH3,在某一温度下达到化学平衡状态。试回答:
⑴若测得N2与H2的平衡浓度相等,求NH3在平衡混合气中的物质的量分数;
⑵若测得平衡混合气体对H2的相对密度为9.2时,求H2的转化率。
28.(6分)在VmLBaCl2溶液中,加入一定体积0.03mol/LH2SO4溶液恰好完全反应后,溶液的pH为2,求原BaCl2溶液的物质的量浓度。
答案及评分标准
选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | B | C | B | B | A | B | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| D | C | C | C | D | B | C | D | B | D |
20.(每一组2分)
| 条 件 | 平衡移动方向 | pH变化 | Fe3+水解程度的变化 |
| 升 温 | A | D | C |
| 通 HCl | B | D | D |
| 加 H2O | A | C | C |
| 加FeCl3 | A | D | D |
| 加 CuO | A | C | C |
21.⑴b-0.3; ⑵0.3≤b≤0.6
22.⑴x+mz/p, y+nz/p; ⑵(nz/ptV)mol/(L·s);
⑶m+n<p+q; ⑷增大
23.⑴1∶10; ⑵4.5×10-5mol/L
24.⑴①②③; ⑵③②①; ⑶①=②>③; ⑷③>②>①
![]()
![]() 25.⑴H2CO3 H++HCO3-, HCO3- H++CO32-;
25.⑴H2CO3 H++HCO3-, HCO3- H++CO32-;
![]() ⑵HCO3-+H2O H2CO3+OH-; ⑶c(Na+)>c(HCO3-)>c(OH-)>c(H+);
⑵HCO3-+H2O H2CO3+OH-; ⑶c(Na+)>c(HCO3-)>c(OH-)>c(H+);
⑷c(HCO3-)+c(OH-)+2c(CO32-); ⑸c(HCO3-)+c(H2CO3)+c(CO32-)
26.⑴60%; ⑵1.4mol/L
27.⑴设有xmolN2转化
![]() N2 + 3H2
2NH3
N2 + 3H2
2NH3
起始量(mol) 3 4 0
转化量(mol) x 3x 2x
平衡量(mol) 3-x 4-3x 2x
3-x=4-3x x=0.5 ω(NH3)=0.5×2/(3+4-0.5×2)≈16.7% (3分)
⑵反应后气体的物质的量为:(3×28+4×2)g/(2×9.2)g/mol=5mol
气体物质的量减少:(3+4)mol-5mol=2mol
即生成NH32mol,转化的H2为3mol,α(H2)=3/4=75% (4分)
28.设消耗H2SO4溶液的体积为xmL
pH=2, c(H+)=0.01mol/L
0.03mol/L×2×xmL/(x+V)mL=0.01mol/L ,x=V/5
BaCl2+ H2SO4 = BaSO4↓+2HCl
1mol 1mol
c(BaCl2)×V=0.03mol/L×V/5, c(BaCl2)=0.006mol/L