高二化学第二学期第二次月测题
2008.5.9
满分150分 时间120分钟
第一部分选择题(共 63 分)
一、选择题(每小题只有一个正确答案,每小题3分,9小题共27分)
1、张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对
原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量
值。则下列关于In的说法中,错误的是 ( )
A.![]() In原子核外有49个电子
In原子核外有49个电子
B.![]() In原子核内有49个中子
In原子核内有49个中子
C.![]() In原子核内质子数和中子数之和等于其质量数,为115
In原子核内质子数和中子数之和等于其质量数,为115
D.![]() In是In元素的一种核素
In是In元素的一种核素
2、金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.越活泼的金属越难冶炼
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.工业上金属Mg、Al都是用电解熔融的氯化物制得的
3、现在含硒的保健品已开始进入市场,已知它与氧同主族与钾同周期,则下列有关硒的叙述中错误的是 ( )
A.原子序数为24 B.最高价氧化物的化学式为SeO3
C.非金属性比溴弱 D.气态氢化物的化学式为H2Se
4、下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.可溶于水 B.具有较高的熔点 C.水溶液能导电; D.熔融状态能导电
5、有关反应:4Al+3TiO2+3C=2Al2O3+3TiC的叙述中正确的是 ( )
A.Al是还原剂,TiC是氧化产物 B.TiO2是氧化剂,TiC是还原产物
C.生成1molTiC转移4mol电子 D.反应中氧化剂与还原剂的物质的量之比是1:1
6、已知在某温度时发生如下三个反应:
(1)C+CO2=2CO (2)C+H2O=CO+H2 (3)CO+H2O=CO2+H2
由此可以推断,在该温度下C、CO、H2的还原性强弱顺序是:( )
A.CO>C>H2 B.C>CO>H2 C.C>H2>CO D.CO>H2>C
7.碱金属与卤素所形成的化合物大都具有的性质是( )
①低熔点 ②水溶液不能导电 ③融融状态能导电 ④晶体能导电
⑤能溶于水 ⑥易溶于苯
A.①②③ B.③⑤ C.④⑤ D.③④⑤⑥
8、在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是 ( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
9、ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A. 1:1 B. 2:3 C. 1:2 D. 2:1
二、选择题(本题包括9小题,每小题4分,共36分,每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
10、设NA为阿伏加德罗常数,下列说法中正确的是 ( )
A. 17gNH4+中含有的电子数为10NA
B. 1mol·L-1 Mg(NO3)2溶液中含有NO3-的数目为2NA
C. 标准状况下,22.4L H2O所含的分子数为NA
D. 室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA,
11.已知:同温度下的溶解度Zn(OH)2 > ZnS > MgCO3 > Mg(OH)2 ,就溶解或电离出S2-的能力而言,FeS > H2S > CuS则以下离子方程式错误的是( )
A.Mg2+ +2HCO3- +Ca2++2OH- = MgCO3 ↓+CaCO3 ↓+2H2O
B.Cu2+ + H2S = Cu S↓+ 2H+
C.Zn2+ +S2-+2H2O = Zn(OH)2↓+ H2S↑
D.FeS +2H+ =Fe2+ + H2S↑
12、常温下测得某无色溶液中由水电离出的![]() ,又知该溶液中还有
,又知该溶液中还有![]() 、
、![]() ,那么该溶液中一定能存在的离子是 ( )
,那么该溶液中一定能存在的离子是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() 、
、![]()
13、用下列实验装置进行的实验中,能达到相应实验目的的是 ( )
![]()
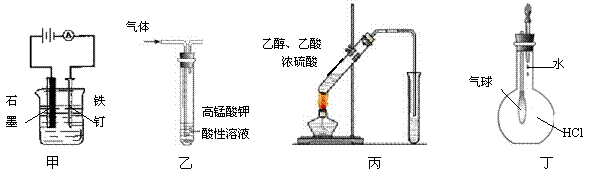
A.装置甲:防止铁钉生锈 B.装置乙:除去乙烯中混有的乙炔
C.装置丙:实验室制取乙酸乙酯 D.装置丁:验证HCl气体在水中的溶解性
14、下列反应的离子方程式书写正确的是 ( )
A.向漂白粉溶液中通入![]() 气体:
气体:
![]()
B.溶液中NH4HSO3与NaOH等物质的量混合:
NH4++HSO3-+2OH-=SO32-+NH3·H2O+H2O
C.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
D.足量的溴化亚铁和少量的氯气反应:
2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
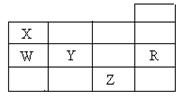 15、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
15、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
16、下列各项中指定的比值是2:1的是 ( )
A.C2H4在氧气中充分燃烧生成的CO2、H2O的物质的量之比;
B.K2S溶液中[K+]与[S2-]之比
C.Na2O2晶体中阳离子与阴离子的物质的量之比;
D.16O原子的中子数和质量数之比
17、将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达平衡:
X(g)+Y(g)![]() 2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
2Z(g);△H<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
A.升高温度,X的体积分数增大
B.增大压强,Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
18.常温下,Va L pH=2的盐酸与Vb L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是
A、Va 一定等于 Vb B、Va 大于或等于 Vb
C、混合溶液中离子浓度一定满足: c(Cl-) > c(NH4+)> c(H+)> c(OH-)
D、混合溶液中离子浓度一定满足: c(NH4+) + c(H+) = c(Cl-)+ c(OH-)
第二部分非选择题(共 87 分)
三、(本题包括3小题,共34分)
19、(14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| 反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中。 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应
化合反应
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶
液中还可以观察到的现象是
解释此现象的有关离子方程式是
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解
产生Mn2+,该反应的离子方程式是
20、(5分)同温同压下,相同体积的CO和CO2相比较,
(1)它们所含的分子数目之比为:
(2)它们所含的O原子数目之比为:
(3)它们所含的C原子数目之比为:
(4)它们所含的原子总数目之比为:
(5)它们所含的电子数目之比为:
21、(15分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)写出该反应的离子方程式:
(5)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
四、(本题包括2小题,共32分)
22、(10分)
现有五种化合物,A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 | Ag+ | Ba2+ | Al3+ |
| 阴离子 | OH- | Cl- | SO42- |
为鉴别它们,分别完成以下实验,其结果是:
① B和D都不溶于水,也不溶于酸;
② A溶于水后,与上述某种阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
③ C溶于水后,与上述某种阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
④ E溶于水后,与上述某种阴离子反应可生成B;
⑤ A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A ,C ,D ,E 。
⑵A溶液与过量的E溶液反应后,最终得到的沉淀的化学式是 。
23、(12分)
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA![]() H++A—,则K==式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A—,则K==式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10— 5 |
| H2CO3 | H2CO3 HCO3— | K1==4.31×10— 7
K2==5.61×10— 11 |
| H2S | H2S HS— | K1==9.1×10— 8
K2==1.1×10— 12 |
| H3PO4 | H3PO4 H2PO4— HPO42— |
K1==7.52×10— 3 K2==6.23×10— 8
K3==2.20×10— 13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________。
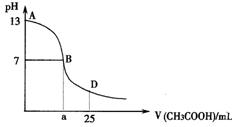 24. (10分)
24. (10分)
I .右图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴
加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,
这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
|
|
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知:a+b=13
(5)该温度下水的离子积常数K w的数值为 。
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
五、(本题包括2小题,共21分)
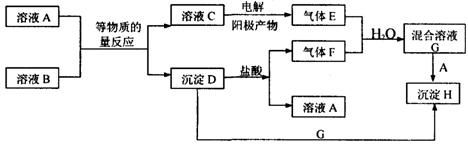 25. (11分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
25. (11分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
若E和F均为有刺激性气味的气体,H不溶于酸,请填写下列空白。
(1)气体E的化学式为 ,气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ;
D+G→H ;
(3)在混合溶液G中滴人几滴石蕊溶液,可见现象为 ,
原因是 。
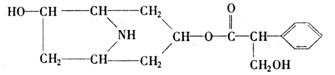 26.(共10分)
26.(共10分)
某有机化合物A的结构简式如右:
(1)A分子式是 。
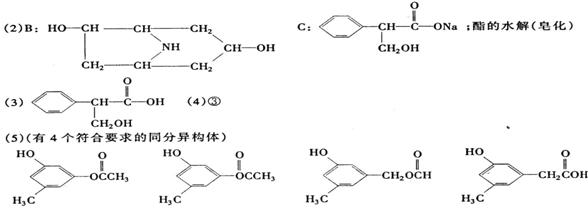
(2)A在NaOH水溶液中加热反应得到B和C,C是芳香化合物。B和C的结构简式是
B: C:
该反应属于 反应。
(3)室温下,C用稀盐酸酸化得到E,E的结构简式是
(4)在下列物质中,不能与E发生化学反应的是(填写序号) 。
① 浓H2SO4和浓HNO3的混合液 ②CH3CH2OH(酸催化) ③CH3CH2CH2CH3 ④Na
⑤ CH3COOH(酸催化)
(5)写出同时符合下列两项要求的E的同分异构体的结构简式(写出其中的两种)。
①化合物是1,3,5-三取代苯
②苯环上的三个取代基分别为甲基、羟基和含有C=O结构的基团。
2007-2008学年度第二学期徐闻高二化学第二次月测题答题卡
高二( )班 姓名 考号
一、二选择题(1~9每题3分,10~18每题4分,共63分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、(本题包括3小题,共34分)
19、(14分)
(1)置换反应
化合反应
(2)现象是 ;
是
(3)①
②
20、(5分)
(1) ;(2) ;(3) ;
(4) ;(5) 。
21、(15分)
(1)
(2) 、 。(3) mol。
(4)
(5)原因是: 。
四、(本题包括2小题,共32分)
22、(10分)
⑴ A ,C ,D ,E 。⑵ 。
23、(12分)(1) __________
(2)
(3) , 。
(4) ;
是
24. (10分)
I . (1) ; 。(若正确,此问不答)
(2) ;(3) ;(4) 。
II.(5) 。(6)pH= 。
五、(本题包括2小题,共21分)
25. (11分)
(1) , , 。
(2)
C→E ;
D+G→H ;
(3) ,
原因是
26.(共10分)(1) 。
(2)B: C:
属于 反应。
(3) (4) 。
(5)
2007-2008学年度第二学期徐闻高二化学第二次月测题答案
高二( )班 姓名 考号
一、二选择题(1~9每题3分,10~18每题4分,共63分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| B | D | A | D | C | B | B | B | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| D | C | D | AD | C | D | C | AC | D |
三、(本题包括3小题,共34分)
19、(14分)
(1)置换反应 2Al+6H+=2Al3++3H2↑或 2Al+3Cu2+=2Al3++3Cu (2分)
化合反应 2Cu+O2+H2O+CO2=Cu2(OH)2CO3 (2分)
(2)现象是 白色沉淀生成,后沉淀逐渐溶解至消失 (2分)
是 Al3++3OH- = Al(OH)3↓ ; Al(OH)3+OH- = AlO2-+2H2O (4分)
(3)① 3MnO2+4Al = 3Mn+2Al2O3 (2分)
② MnO2+H2O2+2H+ = Mn2++O2↑+2H2O (2分)
20、(5分)(每空1分)
(1) 1:1 ;(2) 1:2 ;(3) 1:1 ;
(4) 2:3 ;(5) 7:11 。
21、(15分)
(1) 14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O (3分)
(2) 酸性 (2分)、 氧化性 (2分)。(3) 0.6mol mol。 (2分)
(4) 14H++2NO3-+3Cu2O=6Cu2++2NO↑+7H2O (3分)
(5)原因是:使用了较浓的硝酸,产物中有部分二氧化氮生成 (3分)
四、(本题包括2小题,共32分)
22、(10分)
⑴ A Al2(SO4)3 ,C AlCl3 ,D AgCl ,E Ba(OH)2 。⑵ BaSO4 。(各2分)
23、(12分)(1) 增大 (2分)
(2) K值越大,电离出的氢离子浓度越大,所以酸性越强 (2分)
(3) H3PO4 ,(2分) HPO42— (2分)
(4) K1:K2:K3≈1:10—5:10—10 ( 或答 K1>>K2>>K3, 或答K1远大于K2远大于K3);(2分)
是 上一级电离产生的H+对下一级电离有抑制作用 (2分)
24. (10分)
I . (1) 否 (1分) ; AB (2分)。(若正确,此问不答)
(2) C (1分);(3) D (1分);(4) = (2分)。
II.(5) 10-13或1.0×10-13 (1分)。(6)pH= 12 (2分)。
五、(本题包括2小题,共21分)
25. (11分)
(1) Cl2 , SO2 , NaCl (各1分)。
![]() (2)C→E
(2)C→E
;(2分)
![]() D+G→H
D+G→H
;(2分)
(3) 变红色 (1分)
原因是 A为BaCl2,B为Na2SO3,因A与B是等物质的量混合(Na2SO3+BaCl2=2NaCl+BaSO3↓)所以电解NaCl饱和溶液得到的Cl2和BaSO3与H2SO4反应生成的SO2亦为等物质的量,即Cl2与SO2恰好完全反应:SO2+Cl2+2H2O=2HCl+H2SO4,最终得到C溶液只有酸性而无漂白性。 (3分)
 26.(共10分)(1) C16H2l04N (前6空每空1分,后两空每空2分,共10分)
26.(共10分)(1) C16H2l04N (前6空每空1分,后两空每空2分,共10分)