高二化学秋学期末考试试卷
高二化学(选修)
命题单位:锡山区教研室 制卷单位:无锡市教研中心
注意事项:1.本卷满分120分,考试时间100分钟。
2.可能用到的相对原子质量: H—1、C—12、O—16、I—127
第Ⅰ卷(选择题 共64分)
一、单项选择题(本题共8小题, 每小题4分, 共32分,每小题只有一个选项符合题意)
1.人类的文明和科学技术的发展,对能源的需求不断增大,而天然气、石油、煤等在地球上的蕴藏量很有限,因此使用和开发新能源成为当前国际能源研究的重要课题。下列提供的途径中正确的是:
①利用电解水的方法得到氢气作能源 ②用以高粱、玉米等为原料制得的乙醇作能源
③砍伐大量树木作能源 ④开发太阳能、核能等新的能源
A.①② B.①②④ C.②和④ D.①②③④
2.一定条件下,1g碳与适量水蒸气完全反应生成一氧化碳和氢气,需吸收10.94kJ的热量。则下列热化学方程式正确的是
A.C+H2O = CO+H2 △H=+10.94kJ·mol-1
B.C(s)+H2O(g) = CO(g)+H2(g) △H=+10.94 kJ·mol-1
C.C(s)+H2O(g) = CO(g)+H2(g) △H=-131.3 kJ·mol-1
|
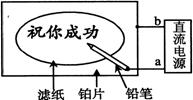 3. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此下列叙述正确的是
3. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此下列叙述正确的是
A.铅笔芯作阳极,发生还原反应 B.铂片作阴极,发生氧化反应
C.铅笔尖附近有少量的氯气产生 D.a是负极,b是正极
4.下列实验操作正确的是
A.用托盘天平称取5.5gKCl固体
B.在酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后再用待测液润洗
C.将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液的pH
D.配制0.1mol·L-1的硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释
5.常温时,将足量的AgCl固体分别加入同体积的下列各溶液中,溶解的AgCl最少的是
A.1 mol·L-1的MgCl2溶液 B.2 mol·L-1的NaCl溶液
C.1.4 mol·L-1的BaCl2溶液 D.1 mol·L-1的AlCl3溶液
6.糖类、脂肪和蛋白质是维持人体生命活动必需的三大营养物质。下列说法错误的是
A.淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体
B.淀粉水解的最终产物能发生银镜反应
C.蛋白质溶液中加入硫酸铜溶液后产生的沉淀不能重新溶于水
D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠
7.下列有关甲苯的描述中,能说明侧链对苯环性质产生影响的是
A.甲苯燃烧产生带浓烟的火焰 B.甲苯能使酸性KMnO4溶液褪色
C.甲苯硝化反应后生成三硝基甲苯 D.甲苯能与H2发生加成反应
8.乙醇分子中各化学键如右图所示,下列说法错误的是
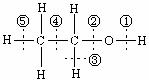 A.和金属钠反应,键①断裂
A.和金属钠反应,键①断裂
B.与氢卤酸反应,键②断裂
C.和乙酸、浓硫酸共热时,键②断裂
D.在铜催化下和氧气反应时,键①和③断裂
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的情况下加入一种试剂,过滤后,再加入适量的盐酸,这种试剂是
A.NH3•H2O B.NaOH C.Na2CO3 D.MgO
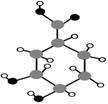 10.某有机物只含有C、H、O三种元素,其分子结构如右图所示。下列关于该有机物的说法,正确的是
10.某有机物只含有C、H、O三种元素,其分子结构如右图所示。下列关于该有机物的说法,正确的是
A.能使紫色石蕊试液变红 B.能发生银镜反应
C.遇FeCl3溶液呈紫色 D.能和溴水发生取代反应
![]() 11.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性。右图有机物发生下列反应后的生成物无光学活性的是
11.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性。右图有机物发生下列反应后的生成物无光学活性的是
A.与甲酸发生酯化反应 B.与NaOH 水溶液共热
C.与银氨溶液作用 D.在催化剂存在下与氢气反应
12.铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法错误的是
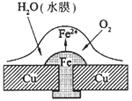 A.正极电极反应式为:2H++2e-=H2↑
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Cu并不被腐蚀
D.此过程中电子从Fe移向Cu
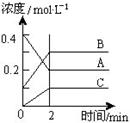 13.右图为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化情况,据此分析不能得出的结论是
13.右图为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化情况,据此分析不能得出的结论是
A.A是反应物,B、C是生成物
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
14.常温下,将2LpH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和氢氧化钠溶液的体积比为
A.5:1 B.6:1 C.10:1 D.11:1
15.乙酸乙酯的实验室和工业制法常采用如下反应:
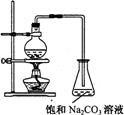
![]() CH3COOH+C2H5OH
CH3COOC2H5+H2O
CH3COOH+C2H5OH
CH3COOC2H5+H2O
若用右图所示的装置来制备少量的乙酸乙酯,下列因素①乙醇挥发;②浓硫酸催化效果较差;③反应温度过高生成乙醚,能导致产率偏低的是
A.只有① B.只有①② C. 只有①③ D.①②③都可以
16.已知0.02 mol·L-1CH3COOH溶液和0.01 mol·L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的
A.c (CH3COO-)>c (Na+)
B.c (Na+) + c (H+) == c (OH-) +c (CH3COOH)+c (CH3COO-)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.01 mol·L-1
第Ⅱ卷 (非选择题共56分)
三、填空题(本题包括4小题,共计29分)
17.(8分)下表是几种常见弱酸的电离平衡常数Ka (25℃)。
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH | 1.76×10-5 |
| H2S | H2S HS- | Ka1=9.1×10-8 Ka2=1.1×10-12 |
| H3PO4 | H3PO4 H2PO4- HPO42- | Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka (填“增大”、“减小”或“不变”)。
(2)同一温度下,各弱酸Ka的大小与酸性的相对强弱关系为
。
(3)若把CH3COOH、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸,Ka1、Ka2、Ka3在数值上相差甚大,如磷酸:Ka1∶Ka2∶Ka3≈1∶10-5∶10-10,造成这种差异的原因可能是 。
18.(6分)核磁共振谱(NMR)是测定有机物分子结构最有用的工具之一。在有机物分子中,不同位置的氢原子在1H核磁共振谱(1H-NMR)中给出的峰值(信号)是不同的,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列有机物分子中,在1H-NMR中只给出一种峰(信号)的是_____(填序号)。
A.C2H6 B.CH3COOH C.HCOOH D.CH3COCH3
(2)化学式为C3H6O2的混合物,在1H-NMR谱上观察氢原子给出的峰有两种情况,第一种情况峰的给出强度为3∶3;第二种情况峰的给出强度为3∶2∶1。由此可推断该混合物的组成可能是(写结构简式): 、 。
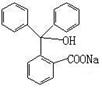
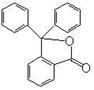
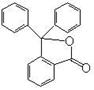 19.(7分)据测定指示剂酚酞的结构简式如右图所示,则:
19.(7分)据测定指示剂酚酞的结构简式如右图所示,则:
(1)酚酞的分子式为 。
(2)1mol酚酞与H2完全加成最多消耗H2 mol。
(3)1mol酚酞与NaOH溶液共热,最多可消耗NaOH mol,
化学方程式为 。
20.(12分)已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
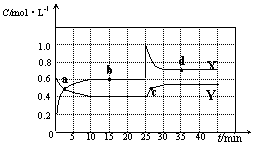 (1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
![]() ②反应2NO2(g) N2O4(g)在b点的平衡常数K(b)=
。
②反应2NO2(g) N2O4(g)在b点的平衡常数K(b)=
。
![]() ③反应2NO2(g) N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
③反应2NO2(g) N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25min时采取的措施是 (填序号)。
A.加入催化剂 B.缩小容器体积 C.加入一定量的NO2 D.加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是 。
四、实验题(本题包括2小题,共计15分)
21.(5分)甲、乙两个同学同时设计了一份表格,用于酸碱中和滴定实验的数据记录和处理。甲同学设计的表格和实验记录结果如下:
| 次数 | V(NaOH)/mL | V(HCl)/mL |
| 1 | 20.48 | 22.46 |
| 2 | 25.00 | 21.98 |
| 3 | 25.00 | 22.36 |
乙同学设计的表格和实验记录结果如下:
| 次数 | V(NaOH)/mL | V(HCl)/mL | ||||
| 始读数V1 | 终读数V2 | V2-V1 | 始读数V1′ | 终读数V2′ | V2′-V1′ | |
| 1 | 0.10 | 25.00 | 0.00 | 24.80 | ||
| 2 | 0.00 | 24.80 | 0.10 | 22.32 | ||
| 3 | 0.00 | 24.80 | 0.00 | 24.70 | ||
请回答下列问题:
⑴你认为甲、乙两同学设计的表格哪个比较合理 (填“甲”或“乙”),你判断的依据是 。
⑵分析你在⑴中选择的表格中的实验数据[若c(HCl)=0.10 mol·L-1],则测得的c(NaOH)=
![]() mol·L-1。
mol·L-1。
22.(10分)已知:CH3CH2OH+NaBr+H2SO4(浓) CH3CH2Br+NaHSO4 +H2O。
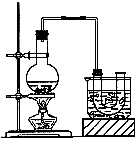 实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按右图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应。
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为
。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取 (填“上层”或“下层”)液体。为了除去其中的杂质,可选择下列试剂中的 (填序号)。
A.Na2SO3溶液 B.H2O C.Na2CO3溶液 D.CCl4
(3)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行 (填操作名称)。
(4)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后 (填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
请写出在此过程中,有溴乙烷参加的主要反应的化学方程式 。
五、计算题(本题包括1小题,共计8分)
23.(8分)将含有C、H、O元素的有机物3.24g装入元素分析装置,通入足量O2,使它完全燃烧,将生成的气体依此通入氯化钙A管和碱石灰B管。测得A管质量增加了2.16g,B管质量增加了9.24g。已知该有机物的相对分子质量为108。
(1)求此有机物的分子式。
(2)若该有机物属于芳香族化合物,试写出其所有可能的结构简式。
高二化学(选修)
一、选择题(4′×8 = 32′)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、选择题(4′×8 = 32′)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三、填空题 (本题包括4小题,共计29分)
17.(8分)(1) 。
(2) 。
(3) , 。
(4) 。
18.(6分)(1)___________(2) 、 。
19.(7分)(1) (2) 。
⑶ , 。
20.(14分)(1) , 。
(2)① ,② ;③ 。
(3)① ,② 。
四、实验题(本题包括2小题,共计15分)
21.(5分)
⑴ , ;
⑵ 。
22.(10分)(1) 。(2) , (填序号)。
(3) (填操作名称)。(4) (填序号);
化学方程式 。
五、计算题(本题包括1小题,共8分)
23.
考试评分标准
一、选择题(32分)
1.C 2.D 3.D 4.A 5.D 6.A 7.C 8.D
二、选择题(32分)
9.CD 10.A 11.B D 12.A 13.C 14.B 15.C 16.A D
三、填空题
17. (1)增大 (2分)
(2)Ka值越大酸性越强 (2分)
(3)H3PO4 HPO42— (2分)
(4)上一级电离产生的H+对下一级电离有抑制作用(2分)
18. (1) AD(2分,少选或选错均不得分);
(2)CH3COOCH3 HCOOCH2CH3 (每空2分)
19. ⑴C20H14O2 (2分);
⑵9 (2分); ⑶1(1分),
|
(2分)
20.(1)X (1分) b和d(2分)
(2)① 0.04 (2分) ②Kb=![]() (mol·L-1)-1(或mol-1·L)(2分) ③ =(2分)
(mol·L-1)-1(或mol-1·L)(2分) ③ =(2分)
(3)① C (2分) ②先变深,再变浅(1分)
四、实验题
21. ⑴甲(1分),记录的数据最好为原始数据 (2分) ⑵0.10 mol•L-1 (2分)
22. (1)Br2 (1分)
![]() (2)下层 (1分) AC(2分) (3)蒸馏(2分)
(2)下层 (1分) AC(2分) (3)蒸馏(2分)
(4)④①⑤③②(2分) CH3CH2Br +NaOH CH3CH2OH+NaBr(2分)
五、计算题

 23. (1)C7H8O(3分)
23. (1)C7H8O(3分)
(2)(各1分)
![]()
![]()