高二化学科上学期期末试题
相关原子质量:N-14 H-1 O-16 C-12 S-32 P-31 Cl-35.5
Na-23 Al-27 Fe-56
一、选择题(每小题2分,共40分)
1、铝用于冶炼难熔的金属,这是因为铝具有[ ]
A、两性 B、优良的导电性 C、低的熔点 D、还原性
2、下列物质属于强电解质的是[ ]
A、醋酸 B、一水合氨 C、碳酸 D、硫酸钡
3、下列微粒中既有氧化性又有还原性的是[ ]
A、Fe B、Fe2+ C、Fe3+ D、H+
4、下列物质中,不能用金属和氯气反应制得的是[ ]
A、CuCl2 B、AlCl3 C、NaCl D、FeCl2
5、实验室欲配制澄清的氯化铁溶液时,可在蒸馏水中加入少量[ ]
A、硫酸 B、硝酸 C、氢氧化钠 D、盐酸
6、常温下,硫酸铁溶液的PH值[ ]
A、大于7 B、小于7 C、等于7 D、不一定
7、下列离子能在溶液中大量共存的是[ ]
A、Al3+,Ba2+,NO3-,OH- B、H+,Cl-,AlO2-,Na+
C、Mg2+,Ca2+, Cl-, NO3- D、Ca2+, Na+,OH-,HCO3-
8、下列微粒中,能发生水解的是[ ]
A、H+ B、Na+ C、Cl- D、Fe3+
9、在氯化氨溶液中, c(NH4+)和c(Cl-)和的关系是[ ]
A、相等 B、c(NH4+)> c(Cl-)
C、c(NH4+)< c(Cl-) D、无法确定
10、下列物质在水溶液中电离时,能生成Cl- 的是[ ]
A、氯化钙 B、次氯酸钠 C、氯酸钾 D、氯水
11、下列反应的离子方程式可以用H++ OH- → H2O表示的是[ ]
A、NaOH和HAc B、KOH和HNO3
C、Ba(OH)2和H2SO4 D、NH3•H2O和HAc
12、下列各项中,能得到氢氧化铝的是[ ]
A、氧化铝加到热水中 B、NaAlO2溶液中加入足量氯化氢
C、铝投入氨水中 D、NaOH滴入足量AlCl3溶液中
13、在常温下,可用铝制容器存放的溶液是[ ]
A、稀硫酸 B、稀硝酸 C、浓硝酸 D、硫酸铜溶液
14、称取两份铝粉,第一份加足量浓氢氧化钠溶液,第二份加足量盐酸,如要放出等体积的气体(在同温同压下),两份铝粉的质量之比是[ ]
A、3:2 B、1:3 C、1:2 D、1:1
15、0.1摩尔/升的氢氧化钠溶液中加入少量无水醋酸后,溶液的导电性[ ]
A、变大 B、变小 C、几乎不变 D、先大后小
16、下列说法正确的是[ ]
A、某物质的水溶液能导电,它就是电解质
B、溶于水后,能电离出氢离子的化合物都是酸
C、在熔融状态下能导电的化合物是离子化合物
D、SO3是电解质
17、下列溶液中导电性最弱的是[ ]
A、1摩尔/升的KNO3 B、0.1摩尔/升的HCl
C、0.5摩尔/升的H2SO4 D、0.1摩尔/升的H2S
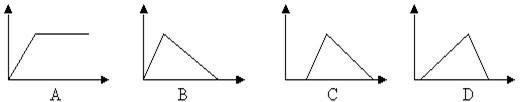
18、向盐酸和氯化铝的混合液中不断滴加氢氧化钠溶液,下列图象中, 能正确表示上述反应的是(横坐标表示加入氢氧化钠溶液的体积, 纵坐标表示反应生成沉淀的质量) [ ]
 19、在物质的量浓度相同、体积相同的盐酸、醋酸、硫酸溶液中,分别加入足量的锌粉,放出的氢气的量是[ ]
19、在物质的量浓度相同、体积相同的盐酸、醋酸、硫酸溶液中,分别加入足量的锌粉,放出的氢气的量是[ ]
A、硫酸放出的H2多 B、醋酸放出的H2多
C、盐酸放出的H2多 D、一样多
20、PH值相同、体积相同的盐酸、醋酸、硫酸溶液中分别加入足量的锌粉,放出的氢气的量是[ ]
A、硫酸放出的H2多 B、醋酸放出的H2多
C、盐酸放出的H2多 D、一样多
二、填空题(共36分)
21、填表
| 盐 | 能否水解 | 水溶液的PH | 溶液的酸碱性 |
| NaCl | |||
| CuSO4 | |||
| Na2CO3 | |||
| NaHSO4 |
22、写出下列物质的电离方程式:
CH3COOH_________________________________
NaHCO3___________________________________
23、pH=3的某酸溶液,若是HCl溶液 ,则c(HCl)=_________摩尔/升,且溶液中c(OH-)=____摩尔/升。
若为H2SO4溶液,则c(H2SO4)=_________摩尔/升。
若是醋酸,则c(CH3COOH)_________ c(HCl)。
24、氨气溶于水形成的饱和溶液中存在以下平衡:
![]()
![]()
![]()
![]()
![]()
(第2拦内填增大、减小、不变)
(1)在氨水中滴加盐酸,平衡向__________反应方向移动,c(NH4+)_______
(2)在氨水中加入KOH固体,平衡向_________反应方向移动,c(NH4+)_______
(3)在氨水中加入NH4Cl 固体,平衡向_________反应方向移动,c(NH4+)_______
(4)升高温度,平衡向_________反应方向移动,c(NH4+)_______
25、写出下列反应的离子方程式:
氯化铝溶液中加入氨水_________________________________________________
氯气通入氯化亚铁溶液中_______________________________________________
醋酸溶液和纯碱溶液混合_______________________________________________
26、将0.1摩尔/升的下列溶液按PH值由小到大的顺序排列______________________
①NaNO3 ②NaOH ③Na2CO3 ④NH4Cl ⑤Ba(OH)2 ⑥HCl ⑦H2SO4
三、实验题(共10分)
27、在氯化亚铁溶液中加入氢氧化钠溶液,产生_________色沉淀,后又变为________色。为了防止氯化亚铁水解,可以在配制时向溶液中加入__________。为了防止氯化亚铁氧化,可以向溶液中加入____________。
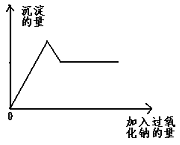
28、某无色透明溶液中可能含Mg2+、Al3+、 Fe3+、Cu2+、NH4+ 、K+中的几种离子。当加入过量的过氧化钠时,有无色无味的气体产生,同时生成白色沉淀。加入的过氧化钠的量与产生沉淀的量之间的关系如右图所示。
(过氧化钠与水反应的方程式为2Na2O2+2H2O→4NaOH+O2↑)试回答:
在溶液中一定有 离子,一定没有 离子,无法确定是否含有 离子。
四、计算题(共14分)
29、2.7克铝与100毫升3摩尔/升的盐酸完全反应。
(!)在标准状况下放出氢气是多少升?
(2)若在反应后的溶液中继续滴加350毫升1摩尔/升氢氧化钠溶液,可得沉淀多少克?
30、把48.8克铁粉和氧化铁粉末的混合物,溶于200毫升稀硫酸中,恰好完全反应,在标准状况下收集到氢气2.24升,且在反应后的溶液中不存在Fe3+ 。求原混合物中铁和氧化铁各为多少克?
高二期末化学科试题
答题纸
一、选择题(每小题2分,共40分)
| 1 | 2 | 3 | 4 | 5 |
| 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 |
二、填空题(每格2分,共36分)
21、填表
| 盐 | 能否水解 | 水溶液的PH | 溶液的酸碱性 |
| NaCl | |||
| CuSO4 | |||
| Na2CO3 | |||
| NaHSO4 |
22、________________________________________________
________________________________________________
23、____________ _______________ _______________ _________________
24、_____________ _____________;_____________ _____________
_____________ _____________;_____________ ____________
25、_________________________________________________
_________________________________________________
_________________________________________________
26、________________________________
三、实验题(共10分)
27、_______________ _________________ ________________ _______________
28、__________________ ____________________ __________
四、计算题(共14分)
29、
30、
答案
一、选择题
| 1D | 2D | 3B | 4D | 5D |
| 6B | 7C | 8D | 9C | 10A |
| 11B | 12D | 13C | 14D | 15C |
| 16C | 17D | 18D | 19A | 20B |
二、填空题(共36分)
21、、填表 (每格1分,共12分)
| 盐 | 能否水解 | 水溶液的PH | 溶液的酸碱性 |
| NaCl | 否 | 7 | 中 |
| CuSO4 | 能 | <7 | 酸 |
| Na2CO3 | 能 | >7 | 碱 |
| NaHSO4 | 否 | <7 | 酸 |
22、写出下列物质的电离方程式:(每个2分,共4分)
略
23、0.001 、10-11、0.0005、> (每个1分,共4分)
24、右,增大; 左,减小; 左,增大; 左,减小 (每个1分,共8分)
25、写出下列反应的离子方程式: (每个2分,共6分)
略
26、7 6 4 1 3 2 5 (2分)
三、实验题(共10分)
27、白色;红褐色;盐酸;铁 (每个1分)
28、Mg2+、Al3+ (2分)
Fe3+、Cu2+、NH4+ (3分)
K+ (1分)
四、计算题(共14分)
29、3.36L (4分 ) 3.9克 (4分)
30、铁16.8克 氧化铁32克 (各2分)