 高二年级化学第二学期期中调研测试
高二年级化学第二学期期中调研测试
化 学(选修) 【命题人:张 军】
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 | 合分人 |
| 得分 |
|
|
|
|
|
|
|
说明:1.本卷满分100分,考试时间75分钟。
2.本卷可能用到的相对原子质量:H:1 C:12 O:16
S:32 Ba:137
第Ⅰ卷(选择题56分)
一、(本题包括8小题,每小题3分,共24分,每小题只有一个正确答案,
请选择的答案填到相应的答案栏中)
1.强弱电解质的本质区别是
A.溶解度 B.电离程度 C.导电能力 D.相对分子质量
2.下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是
A.KNO3、CH3COOH、NH3 B.BaSO4、H3PO4、H2O
C.HCl、CaCO3、SO2 D.HClO、H2S、C2H5OH
3.1 mol 下列物质,在水中能电离出3 mol 离子的是
A.H2S B.Fe2(SO4)3 C.Ba(OH)2 D.NaCl
4.下列说法一定正确的是
A.氯水能导电,所以Cl2也是电解质
B.弱电解质溶液中存在两种共价化合物分子
C.BaSO4投入水中,导电性较弱,故它是弱电解质
D.强电解质溶液的导电性比弱电解质溶液的导电性强
5.在0.1mol/L的CH3COOH溶液中,要促进醋酸电离,且氢离子浓度增大,应采取的措施是
A. 加入NaOH溶液 B. 降温 C. 升温 D. 加入稀HCl
6.下列叙述中,能证明某物质是弱电解质的是
A.熔化时不导电
B.溶液中已电离的离子和未电离的分子共存
C.水溶液的导电能力很差
D.不是离子化合物,而是极性共价化合物
7.下列各式中,属于正确的电离方程式的是
A.H2O +H2O ![]() H3O++OH- B.HCO3-+H2O
H3O++OH- B.HCO3-+H2O ![]() H2CO3+OH-
H2CO3+OH-
C.NH3·H2O ![]() NH4+ + OH-1 D.H2S = 2H++S2-
NH4+ + OH-1 D.H2S = 2H++S2-
8.下列说法正确的是
A.强电解质一定是离子化合物
B.强电解质的饱和溶液一定是浓溶液
C.强电解质、弱电解质的电离都是吸热过程
D.强电解质在水中一定能全部溶解
二、(每小题有1~2个选项符合题意,每小题4分,共32分。若有两个选项且均正确得3分。少选且选对1个得2分,错选、多选均不得分。)
9.下列措施对水的电离无影响的是
A.升高温度 B.加入稀醋酸
C.加入醋酸钠 D.加入食盐
10.关于溶液的酸碱性说法正确的是
A. c(OH-)=c(H+)的溶液一定呈中性
B. pH=7的溶液一定呈中性
C. c(H+)很小的溶液一定呈碱性
D. 不能使酚酞试液变红的溶液一定呈酸性
11.下列溶液肯定是酸性的是
A.含H+的溶液 B.pH<7的溶液
C.加酚酞显无色的溶液 D.c(OH-)<c(H+)的溶液
12.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处.把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.为10.0mL B.小于40.0mL
C.为40.0 mL D.大于40.0mL
13.在0.1mol/L的醋酸溶液中加入少量硫酸后,其变化结果是
A.酸性增强,PH值减小 B.醋酸的浓度减小
C.氢离子的浓度变小 D.醋酸根离子的浓度变
14.等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1
C.V3>V2=V1 D.V1=V2>V3
![]()
![]() 15.水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
15.水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是
A. B.
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
16.用标准盐酸滴定末知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是
A. 滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B. 酸式滴定管用蒸馏水洗后,未用盐酸润洗
C. 滴定前,滴定管尖端处有气泡,而在滴定后滴定管尖端处气泡消失
D. 滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
一、二选择题(两题共16小题,1~8,每小题3分,9~16,每小题4分,共56分。)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
第Ⅱ卷(非选择题44分)
三、(本题共2大题,共16分)
17.(10分)请根据以下实验内容填写实验报告(实验现象、实验解释或实验结论)
以下实验均在室温下进行
| 实验内容 | 混合溶液 的pH (填>,<或=) | 实验解释: (用化学方程式中离子方程式和简要文字说明 ) |
| ①0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合 | pH= 7 | |
| ②pH=1 CH3COOH溶液 与pH=13 NaOH溶液体积混合 | pH= 7 |
![]() 18.(6分)在氢氟酸溶液中,存在如下电离平衡:HF H+
+ F-
18.(6分)在氢氟酸溶液中,存在如下电离平衡:HF H+
+ F-
⑴ 加入固体NaOH ,电离平衡向________反应方向移动, c(H+)_______________。
⑵ 加入固体NaF , 电离平衡向________反应方向移动 , c(H+)____________。
⑶ 升高温度,电离平衡向__________反应方向移动,c(H+)_________________。
四、(本题共2大题,共20分)
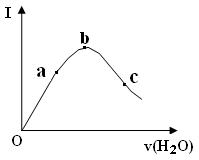 19.(8分)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力(I)如图所示。请根据图象回答:
19.(8分)在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力(I)如图所示。请根据图象回答:
⑴“O”点的导电能力为0的理由是
。
⑵ a、b、c三点中电离度最小的是 。
⑶ a、b、c三点,溶液酸度由大到小的顺序是
⑷ 若设c点溶液中,c(CH3COO-)增大,溶液的pH也增大,可采取的措施是
①
②
20.(共12′) 某学生用标准的0.2mol/L的盐酸滴定待测的NaOH溶液,其实验操作如下:
A.用碱式滴定管取待测液NaOH溶液放入锥形瓶,滴加2—3滴酚酞指示剂。
B.用待测的NaOH溶液润洗碱式滴定管。 C.把滴定管用蒸镏水洗净。
D.取下酸式滴定管,用标准的盐酸溶液润洗后,再将标准的盐酸注入酸式滴定管至刻度“0”以上2cm—3cm处,把酸式滴定管固定好,调节液面。
E.检查滴定管是否漏水,并分别固定在滴定管架两边。
F.另取锥形瓶,再重复滴定操作一次。
G.把锥形瓶放在酸式滴定管的下面,瓶下垫一张白纸,然后边滴定边摇动锥形瓶,直至终点,记下滴定管的液面所在刻度。
据上述滴定操作,完成下列填空:
⑴ 滴定操作的正确操作顺序是(用上述各编号字母填写)
→E→ →B→ → → ;
⑵ G步操作中判断滴定终点的依据是 ;
⑶ D步骤的操作中液面应调节到 ,尖嘴部分应 ;
⑷ 酸式滴定管未用标准的盐酸润洗,待测溶液NaOH的测定值会 ;碱式滴定管未用待测的NaOH溶液润洗,待测NaOH溶液的测定值会 。(填“偏高”、“偏低”或“无影响”。)
五、(本题共8分)
21. (共8′) 向100mL稀硫酸和稀盐酸的混合溶液中加入3.42g氢氧化钡,充分反应后,过滤、干燥得沉淀2.33g,经测定滤液pH=13.试求原混合溶液中硫酸和盐酸的物质的量浓度分别是多少?