高二年级化学能力测试题[7]
[ ]1.用铝热法还原下列化合物,制得金属各1mol,消耗铝最少的是
A.Fe3O4 B.MnO2 C. WO3 D.Cr2O3
[ ]2. 下列不能由单质直接化合而得到的化合物是
A. FeCl2 B. Al2S3 C. FeS D. Fe3O4
[ ]3.下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变成游离态时,该元素一定被还原 D.金属阳离子被还原不一定得到金属单质
[ ]4.下列叙述正确的是
A.常温下铝和浓硫酸、浓硝酸不反应
B.工业上常利用铝热反应冶炼难熔的金属,如钒、铬、锰等
C.合金的熔点一般比组成它的各成分的熔点都高
D.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应时,产生的氢气前者较多
[ ]5.向某溶液中加入含Fe2+的溶液后,无明显变化。当再加入几滴新制氯水后,混合液变成红色,则下列结论中错误的是
A.该溶液中一定含SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化为Fe3+
[ ]6.某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是
A.Cl-、NO3-、Ba2+、Na+ B.Na+、、K+、SO42-、Cl-
C.NH4+、Ba2+、Cl-、HCO3- D.SO42-、CH3COO-、Al3+、Mg2+
[ ]7.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A.Fe3+ B.Fe2+ C.Al3+ D.NH4+
[ ]8.将下列物质的溶液,加热蒸干并灼烧,能够得到原来物质的是
A.FeCl3 B.NaHCO3 C.碳酸氢镁 D.Na2CO3
[ ]9.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当向两个烧杯中分别加入0.1mol两种金属充分反应后,而在某一端要再放一个0.2克砝码,天平才能平衡,则这两种金属是
A.Mg和Al B.Al和Fe C.Fe和Cu D.Na和Mg
[ ]10. 某稀硝酸能与5.4g铝恰好反应,当这份酸在与铁反应时,最多消耗铁的量为
A. 26.8g B. 0.3mol C. 11.2g D. 0.2mol
[ ]11. 向一定量的Fe、FeO、Fe2O3的混合物中加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(S、T、P)的气体。所得溶液中加入KSCN溶液无血红色出现,混合物中铁元素质量分数为
A. 68.6% B. 77.8% C. 81.4% D. 无法计算
[ ]12. 在我国近年来报道的高温超导体中,铊(Tl)是组成成分之一。已知铊和铝是同族元素,关于铊的性质的推断可能错误的是
A.是银白色的软质金属 B. 能生成+3价的离子化合物
C.与硝酸作用能放出氢气并生成硝酸盐 D.铊的密度大于铝
[ ]13.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
[ ]14.物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是
A.Na2CO3溶液 B.NH4HCO3溶液 C.NaHCO3溶液 D.NaHSO4溶液
[ ]15.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.硝酸铜 C.稀盐酸 D.氢氧化钠
[ ]16.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
[ ]17. a g Na和Al的混合物,加入到b g水中,待反应停止后,经测定生成的沉淀为c g,则滤液中的溶质是
A.NaOH B.NaOH和NaAlO2 C. NaAlO2 D. 无法判断
[ ]18. 铜、镁的合金4.6g完全溶解于浓硝酸中,若反应中硝酸被还原产生4480mlNO2气体和336mlN2O4气体(都已折算成标准状况),在反应后的溶液中加入足量的NaOH溶液,最终得到的沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
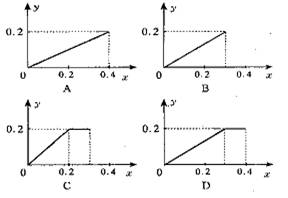 [ ]19. 将22.4g铁粉逐渐加入到含HNO30.8mol的稀硝酸中,反应生成的气体的物质的量(y)随消耗铁粉的物质的量(x)变化关系如图. 正确的关系图是
[ ]19. 将22.4g铁粉逐渐加入到含HNO30.8mol的稀硝酸中,反应生成的气体的物质的量(y)随消耗铁粉的物质的量(x)变化关系如图. 正确的关系图是
[ ]20.把铝粉和某铁氧化物xFeO·yFe2O3粉末配成铝热剂,再分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放人足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5:7,则x : y为
A.1 : 2 B.1 : 1 C. 5 : 7 D. 7 : 5
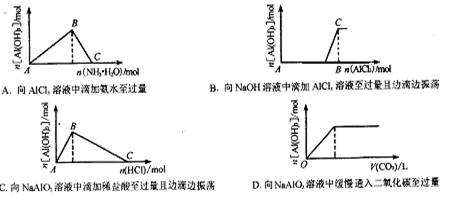
[ ]21.下图所示的实验过程中产生的现象与对应的图形不相符合的是
[ ]22.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):下列计算结果正确的是
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
A.硝酸的浓度为5mol/L B.①中溶解了5.6gFe
C.②中溶解了9.6gCu D.④中V=8960
[ ]23.下列有关金属元素特征的叙述正确的是
A. 金属元素的原子只有还原性而离子只有氧化性
B. 金属元素的单质在常温下均为固体
C. 金属元素在不同化合物中化合价均相同
D. 金属元素在化合物中一定显正价
24.(1)等物质的量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是___
(2)等质量的钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是 。
(3)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的物质的量之比是 。
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝的质量之比是 。
(5)把0.5 mol钠投入到ml g水(过量)中得到a溶液,把0.5 mol镁投入到m2 g盐酸(过量)中得到b溶液,若m l=m2,则a、b的质量大小关系是a b
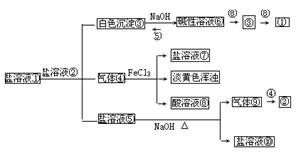 25.下列框图中气体④⑨均具有刺激性气味,回答
25.下列框图中气体④⑨均具有刺激性气味,回答
下列问题:
(1)①是(填化学式.下同) ;
正盐②是 。
(2)④通入FeCl3溶液中的离子方程式
(3)⑤滴入⑥中产生白色沉淀③的原因用离子方程式
表示是
(4)若将NaHCO3溶液滴入⑥中能否产生③? (填能或不能)。
26.向含bmolAlCl3溶液中逐滴加入含amolNaOH溶液。试回答:
⑴ 依次写出溶液中发生反应的化学方程式:
⑵若 a+b =1 mol,当a取不同值时,含Al元素的生成物可能有如下情况:
(Ⅰ)全部是Al(OH)3 ,a 的取值范是 ;
(Ⅱ)全部是NaAlO2 ,a 的取值范是 ;
(Ⅲ)部分是NaAlO2,部分是Al(OH)3,a 的取值范围是 。
反应所生成的Al(OH)3的物质的量为 mol,反应所生成的各物质的总物质的量(包
括水)为_______________mol(后两空用含b的式子表示)。
(Ⅳ)在上述条件下,若要生成7.8g沉淀,则 a 的值等于 或 。
27.有一包固体粉末可能含有Cu2+、Al3+、Mg2+、Cl- 、SO42-、CO32-中的若干种,现进行以下实验:①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出,②向①溶液中加入Ba(NO3)2溶液,无沉淀生成,再滴入AgNO3溶液,有白色沉淀生成 。③再取少量固体加入适量蒸馏水,搅拌后,固体全部溶解,得到无色透明溶液。④向③的溶液中加入氨水,使溶液呈碱性,有沉淀生成,过滤。向过滤所得沉淀中加入过量的氢氧化钠溶液,沉淀部分溶解。这包固体粉末中一定不含有的离子是
肯定含有的离子是 ,这包固体粉末的组成
物是 。
28.将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL0.5mol /LFeSO4溶液和5.2 g固体沉淀物。
(1)反应后生成铜的质量为 ;
(2)原Fe2(SO4)3溶液的物质的量浓度为 。
29.已知:下图中A是金属铁,请根据图中所示的转化关系,回答下列下问题:
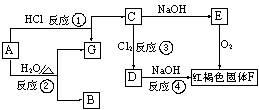
(1)写出E的化学式 ;
(2)写出反应②③的化学方程式:
② 、③ ;
(3)、写出①④在溶液中反应的离子方程式:
① 、 ④ 。
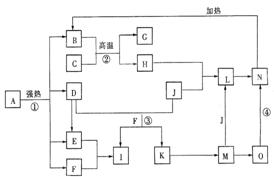 30.仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:
30.仔细阅读下图,已知B、D、E、F、G是氧化物,F、K是氢化物;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A分解的化学
方程式为 。
(2)写出反应②在工业生产上的一种用途
(3)反应③的离子方程式为;
反应④的化学方程式为 。
(4)常以C或H制成容器盛装和运输I的浓溶液,其原理是 。
参考答案
1D 2A 3D 4B 5B 6B 7C 8D 9A 10B 11C 12C 13B 14C 15B 16C 17C 18B 19C 20A 21A 22D 23D
24.(1)1:2:3
(2)1/23:1/12:1/9 或36:69:96
(3)6:3:2
(4)23:12:9
(5)m(a)=m(b)
25.(1)①是 AlCl3 ;正盐②是 (NH4)2S 。
(2)④通入FeCl3溶液中的离子方程式 H2S+2Fe3+=2Fe2++S ↓ +2H+
(3)⑤滴入⑥中产生白色沉淀③的原因是 NH4++AlO2-+H2O=NH3 ↑+Al(OH)3↓
(4)若将NaHCO3溶液滴入⑥中能否产生③? 能 (填能或不能)。
26.⑴ AlCl3+3NaOH=Al(OH)3↓+3NaCl Al(OH)3+NaOH =NaAlO2+2H2O
⑵
(Ⅰ) 0 < a ≤0.75
(Ⅱ) 1 > a ≥.0.8
(Ⅲ) 0.75 < a <0.8 5b-1 2-4b
(Ⅳ) 0.3 或 0.78
27. Cu2+、SO42-、CO32-; Al3+、Mg2+、Cl- ;MgCl2 AlCl3
28. 2.56g 0.1mol/L
29.(1) Fe(OH)2
(2) 3Fe + 4H2O ![]() Fe3O4 +4H2 2FeCl2
+ Cl2 == 2FeCl3
Fe3O4 +4H2 2FeCl2
+ Cl2 == 2FeCl3
(3) Fe + 2H+ == Fe2+ + H2 ↑ Fe3+ + 3OH— == Fe(OH)3↓
30.⑴ 2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
⑵ 焊接钢轨(或冶炼钒、铬、锰等金属)
⑶ SO2+Cl2+2H2O=4H++SO42-+2Cl- 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑷ 铝或铁遇冷的浓硫酸会发生钝化。