高二年级化学能力测试题[8]
[ ]1.下列说法中,正确的是
A.凡能导电的物质一定是单质 B.金属单质都能与稀硫酸发生置换反应
C.活泼金属都能从盐溶液中置换出较不活泼的金属 D.在化学反应中金属失电子,常作还原剂
[ ]2.下列性质的比较中,错误的是
A.熔、沸点:K>Na>Li B.原子半径:Ca>Mg>Al C.活动性:K>Ca>Na D.氧化性:Ag+>Cu2>Mg2+
[ ]3.金属的下列性质不属于物理性质的是
A.反应中易失去电子 B.良好的延展性 C.良好的导电传热性 D.良好的可塑性
[ ]4.要使氯化铝溶液中的Al3+完全转化成Al(OH),沉淀,应选用的适宜试剂是
A.NaOH溶液 B.稀HCl C.氨水 D.AgNO3溶液
[ ]5.工业上制造镁粉是将镁蒸气在气体中冷却。可作为冷却气体的是
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.②③ C.③④ D.④⑤
[ ]6.往下列物质的溶液中通入CO2气体,有白色沉淀产生的是
A.MgCl2 B.Al(NO3)3 C.CaCl2 D.NaAlO2
[ ]7.下列物质在常温下混合后,明显有气体放出的是
A.铝与浓销酸 B.铝与稀硝酸 C.镁与烧碱溶液 D.铜与稀盐酸
[ ]8.相同质量的镁条分别在①氧气、②氮气、③二氧化碳中充分燃烧,所得固体物质的质量大小排列顺序正确的是
A.①>②>③ B.③>②>① C.②>①>③ D.③>①>②
[ ]9.将溶液中的Mg2+、Al3+分离,可选用的试剂是
A.氨水 B.NaOH与HNO3 C.盐酸 D.K2CO3溶液
[ ]10.下列物质属于复盐的是
A.绿矾 B.明矾 C.胆矾 D.石膏
[ ]11.能直接由金属单质与酸反应得到的盐是
A.Fe(NO3)3 B.CuCl2 C.FeCl3 D.AgCl
[ ]12.用一种试剂就可以将NaOH、NH4SCN、AgNO3、Na2SO4四种无色溶液一一鉴别出来,这种试剂是
A.溴水 B.FeCl3 C.Fe(NO3)3 D.BaCl2
[ ]13.下列化学方程式书写正确的是
A.2Fe+6HCl═2FeCl3+3H2↑
B.FeO+2HNO3═Fe(NO3)2+H2O C.3Fe3O4+8Al![]() 9Fe+4Al2O3
D.Cu+S
9Fe+4Al2O3
D.Cu+S![]() CuS
CuS
[ ]14.正在燃烧的镁条,放入下列气体中,不能继续燃烧的是
A.He B.Cl2 C.N2 D.CO2
[ ]15.下列物质中不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
[ ]16.下列物质充分反应后,滴入KSCN溶液,显红色的是:①FeS+HCl(溶液) ②FeCl2(溶液)+Cl2 ③Fe+CuSO4(溶液) ④Fe2O3+H2SO4
A.②④ B.①② C.③④ D.①④
[ ]17.现有下列4种物质:①NaHCO3 ②Al(OH)3 ③(NH4)2CO3 ④Al,其中既能与NaOH溶液反应,又能与盐酸反应,且都有气体生成的一组是
A.①③ B.③④ C.①④ D.②④
[ ]18.将Na、Mg、Al各0.3mol分别放入100mL 1mol·L-1的盐酸中,同温同压下产生气体的体积比为
A.1︰2︰3 B.6︰3︰2 C.3︰1︰1 D.1︰1︰1
[ ]19.将物质的量浓度相同的明矾溶液与Ba(OH)2溶液按体积比为1︰2充分混合,此时铝元素的主要存在形式是
A.Al(OH)3 B.AlO2 — C.Al(OH)3和AlO2— D.Al3+和Al(OH)3
[ ]20.对室温下pH相同、体积相同的盐酸和醋酸两种溶液分别采取下列措施,有关叙述一定正确的是
A.加适量CH3COONa晶体后,两溶液pH均增大
B.滴入甲基橙试剂,两溶液均显红色
C.加水稀释2倍后,两溶液pH均减小
D.加足量的Zn粉充分反应后,两溶液中产生的H2一样多
[ ]21.能正确表示下列反应的离子方程式是
A.碳酸钠溶液和醋酸反应:2H+ + CO32-═CO2↑+H2O
B.Na2S水解:S2-+2H2O![]() H2S+2OH—
H2S+2OH—
C.镁粉撒入NH4Cl溶液:Mg+2H+═Mg2++H2↑
D.Mg(HCO3)2溶液和足量NaOH溶液反应Mg2++4OH—+2HCO![]() ═Mg(OH)2↓+ 2CO
═Mg(OH)2↓+ 2CO![]() +2H2O
+2H2O
[ ]22.恒温下,在一个可变容积的密闭容器中发生如下反应:A(g)+B(g)![]() C(g),已知开始时放入1mol A和1mol
B,到达平衡后,生成a mol C;若开始时放入x mol A, 2mol B和1mol C,到达平衡后,C的物质的量是3a mol,则x为
C(g),已知开始时放入1mol A和1mol
B,到达平衡后,生成a mol C;若开始时放入x mol A, 2mol B和1mol C,到达平衡后,C的物质的量是3a mol,则x为
A.1mol B.2mol C.3mol D.4mol
[ ]23.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)=c(SO42-) B.c(NH4+)<c(SO42-)
C.c(NH4+)>c(SO42-) D.c(OH-)+c(SO42-)=c(H+)+c(NH4+)
[ ]24.某溶液中加入铝粉能产生氢气,则该溶液中肯定不能大量共存的离子组是
A.NH4+、NO3-、Cl—、Na+ B.Na+、 Al3+、H+、Cl-
C.NO3-、Ba2+、K+、Cl- D.NO3-、K+、AlO2-、OH-
[ ]25.在VL Al2(SO4)3 溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得白色固体m g,溶液中SO42―的物质的量浓度是
A. m / 27V mol·L-1 B. 2m / 27V mol·L-1
C. 3m/54V mol·L-1 D. 3m/102V mol·L-1
[ ]26.把0.2mol铝投入100mL 3mol/L的NaOH溶液中充分反应后,再加入1mol/L的H2SO4溶液200mL,其结果是
A.充分反应后还剩余H2SO4
B.反应结束后的溶液中铝元素存在的形式是Al3+ 和Al(OH)3
C.反应结束后的溶液中铝元素存在的形式是AlO2- 和Al(OH)3
D.反应结束后得到的是澄清溶液
[ ]27.已知等物质的量浓度的NaHCO3与偏铝酸钠溶液比较,C(HCO3-)比C(AlO2-)大得多,则下列推论中正确的是:
 A.通入适量CO2于AlO2- 溶液中,没有Al(OH)3生成;
A.通入适量CO2于AlO2- 溶液中,没有Al(OH)3生成;
B.等物质的量浓度的NaHCO3和NaAlO2溶液比较,前者PH大于后者PH;
C.Al(OH)3可以溶于氨水和碳酸
D.H+、AlO2-、HCO3-
不能大量共存于同一溶液。
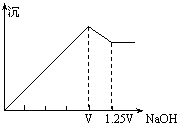
[ ]28.有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的体积关系如图所示,则溶液中c(Cl—)与c(SO![]() )之比为
)之比为
A.1︰1 B.2︰3 C.3︰2 D.2︰1
[ ]29.如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A.浓硝酸和铜反应制备NO2 B.浓盐酸和二氧化锰反应制备氯气
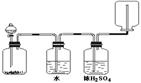 C.锌和盐酸反应制备氢气 D.碳酸钙和盐酸反应制备二氧化碳
C.锌和盐酸反应制备氢气 D.碳酸钙和盐酸反应制备二氧化碳
[ ]30.单质X都能从盐的溶液中置换出单质Y,由此可知
A.当X、Y都是金属时,X没有Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y可能是金属,也可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
[ ]![]() 31.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是
31.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化(其中m≠n,且均为正整数)。下列说法正确的是
A.若X为Fe,Y可为Cl、Br、I B.若X为Fe,Y只能为Cl
C.X一定为金属元素 D.X、Y可能均为非金属元素
[ ]32. U(铀)是重要的核工业原料,常见化合价有+4和+6。硝酸铀酰[UO2(NO3)2]加热可发生分解:UO2(NO3)2 → UxOy+NO2↑+O2↑,在600 K时,将气体产物集于试管并倒扣水中,水充满试管。则生成铀的氧化物化学式是
A.UO2 B.UO3 C.2UO2·UO3 D.UO2·2UO3
33.在一定条件下,反应A(气)+B(气)![]() C(气) ( 正反应放热)
达到平衡后,根据下列图象判断
C(气) ( 正反应放热)
达到平衡后,根据下列图象判断
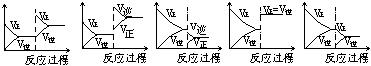
A. B. C. D. E.
(1)升温,达到新的平衡的是 ;(2)降压,达到新的平衡的是 ;
(3)减少C的量,移向新平衡的是 ;(4)增加A的量,移向新平衡的是 。
34.工业上冶炼金属一般用以下几种方法,①热还原法②电解法③热分解法④铝热法。现冶炼下列金属,请选择适宜的冶炼方法(填序号):
Al、Mg ,Fe、Cu ,Mn、Cr ,Hg、Ag 。
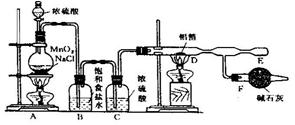 35.无水氯化铝是白色晶体,易吸水,在178℃升华。无水氯化铝试剂在潮湿的空气中,会产生大量的白雾。制备无水的氯化铝可以采用下面的两种方法。
35.无水氯化铝是白色晶体,易吸水,在178℃升华。无水氯化铝试剂在潮湿的空气中,会产生大量的白雾。制备无水的氯化铝可以采用下面的两种方法。
![]() 方法一:某课外兴趣小组在实验室用铝和氯气反应制备:
方法一:某课外兴趣小组在实验室用铝和氯气反应制备:
(1)装置B的作用是 ,
装置F的作用是 。
(2)在E处可收集到纯净的氯化铝,其原因是
(3)无水氯化铝在潮湿空气中发生的反应方程式为
方法二:从矿石中提取AlCl3溶液,将溶液蒸发浓缩结晶可得到AlCl3·6H2O。
(1)若将AlCl3溶液直接蒸干能否得到无水氯化铝?
(2)由AlCl3·6H2O制取无水氯化铝的方法是
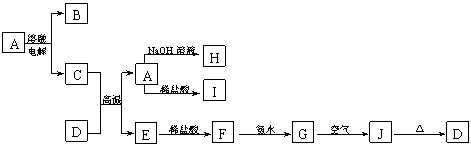 36.A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀,H的焰色反应呈黄色。
36.A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀,H的焰色反应呈黄色。
请回答下列问题:
(1)A物质的化学式为 ,H物质的名称为 。
(2)G→J的化学方程式为 。
(3)C+D→A+E的化学方程式为 。
(4)D物质与盐酸反应的离子方程式为 ,
所得溶液显酸性的原因(用离子方程式表示)是 。
37.某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的KW=_________ 在此温度下,将pH=a的NaOH溶液V(a)L与pH=b的H2SO4 溶液V(b)L混合(不考虑混和后体积变化)。
(1)若所得混合液为中性,且a=12,b=2,则V(a):V(b)= ___________;
(2)若所得混合液为中性,且a+b=12,则V(a):V(b)= ____________;
(3)若所得混合液的pH=10,且a=12,b=2,则V(a):V(b)= _________。
38.在100mL 0.6mol·L-1 AlCl3溶液中,滴加475mL 0.4mol·L-1 NaOH溶液,计算所得Al(OH)3的质量为 克.
39.为确定某铝热剂(含三氧化二铁和铝)的组成,分别进行下列实验。
⑴ 若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标况,下同)体积为b L。反应
的化学方程方式 ;
样品中铝的质量是 g。
⑵ 若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是
三氧化二铁和铝的质量比是 。
⑶ 待⑵中反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与⑴中所得气体的体积比c︰b= 。
40.为使溶液中的三种阳离子A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+三种阳离子的水溶液进行如下实验
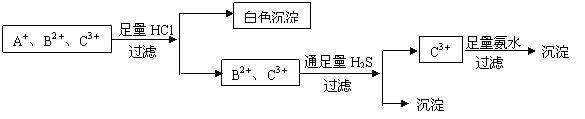
(1)写出过滤操作用到的玻璃仪器名称: 。
(2)C3+可能是Al3+或Fe3+吗?为什么?
(3)B2+离子可能是Fe2+吗?为什么?
参考答案
1D 2A 3A 4C 5C 6D 7B 8D 9B 10B 11A 12B 13C 14A 15D 16A 17B 18C 19B 20A 21D 22B 23C 24A 25D 26B 27D 28B 29C 30C 31D 32B
33. (1) B_________ (2) ____C_____ (3) _E________ (4) ____A___
34. ② ① ④ ③
35..方法一: (1)除去Cl2中的HCl ;防止空气中的水蒸汽进入容器 (2)AlCl3易升华变成气体在E处冷却为固体;
(3)AlCl3+3H2O=3HCl+Al(OH)3
方法二:(1)不能; (2)在HCl的气流中加热
36. (1)Al2O3;偏铝酸钠 (2)4Fe(OH)2+2H2O+O2═4Fe(OH)3
(3)2Al+Fe2O3 Al2O3+2Fe
(4)Fe2O3+6H+═2Fe3++3H2O; Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
37. KW=1×10-13;(1)1:10 (2)10:1 (3)1:9
38.生成Al(OH)3 3.9g。
39.⑴ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ![]()
⑵ 2Al+Fe2O3=Al2O3 +2Fe 80︰27 ⑶ 2︰3
40.①烧杯 玻璃棒 漏斗
②C3+可能为Al3+ 而不可能为Fe3+,因为Fe3+与H2S反应生成Fe2+和S等
③B2+不可能为Fe2+,因为Fe2+与H2S不反应,不能形成沉淀。