高二年级化学能力测试题[9]
[ ]1.2007 年诺贝尔化学奖授予德国科学家格哈德 · 埃特尔以表彰他在表面化学研究领域作出的开拓性贡献。其中对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快 CO 氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2 可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
[ ]2.下列物质的制备方法正确的是
A 氯化铝溶液和硫化钠溶液反应制备Al2S3 B 用镁粉和空气反应制备Mg3N2
C 用铝粉和MnO2制得锰 D 用电解熔融氯化铝的方法制得单质铝
[ ]3.某溶液中含有Na+、NH4+、HCO3-、CO32-、SO32-..CH3COO-等6种离子。若向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是
A. CH3COO- B.Na+ C.CO32- D.SO32-
[ ]4.能正确表示下列反应的离子方程式是
A.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++4H2O+NO↑
B.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+
C.醋酸溶液与纯碱反应:CO32- +2H+=+H2O+CO2↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
[
]5.在密闭容器中有可逆反应:nA(g)+mB(g)![]() pC(g);△H>0处于平衡状态,(已知m+n>p),则下列说法:①升温,c(B)/c(C)的比值变小②降温时体系内混合气体平均分子量变小 ③加入B,A的转化率增大④加入催化剂,气体总的物质的量不变 ⑤加压使容器体积减小,A或B的浓度一定降低⑥若A的反应速率为VA,则B的反应速率为VAn/m 正确的是
pC(g);△H>0处于平衡状态,(已知m+n>p),则下列说法:①升温,c(B)/c(C)的比值变小②降温时体系内混合气体平均分子量变小 ③加入B,A的转化率增大④加入催化剂,气体总的物质的量不变 ⑤加压使容器体积减小,A或B的浓度一定降低⑥若A的反应速率为VA,则B的反应速率为VAn/m 正确的是
A.①②③⑤ B.①②③④ C.①②⑤⑥ D.③④⑤⑥
[ ]6.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法错误的是
 A.合金的化学性质与成分金属的化学性质不同
A.合金的化学性质与成分金属的化学性质不同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属腐蚀的本质是金属原子失去电子变成阳离子
D.若金属铁中混有金属锌,则铁不易发生电化学腐蚀
[ ]7.上图所示的反应均是在高温或引燃后进行。选项中的物质表示A和B,不合理的是
A.CO2、Mg B.MgO、Al C.Fe3O4、Al D.CuO、H2
[ ]8.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Cu2+ S2- Br- ClO- B.K+ Ba2+ OH- I-
C.Na+ H+ Cl- NO3- D.Na+ Mg2+ Cl- SO42-
[
]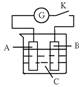 9.如下图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是
9.如下图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是
A.A是Cu、B是Zn、C是CuSO4溶液 B.A是Fe、B是Fe、C是H2SO4溶液
C.A是Zn、B是石墨、C是稀H2SO4溶液 D.A是石墨、B是Zn、C是CuSO4溶液
[ ]10.将甲、乙两种金属的性质相比较,已知①甲跟H2O反应比乙与H2O反应剧烈;②甲单质能从乙的盐溶液中置换出单质乙;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
A.①④ B.③⑤ C.①②③ D.①②③④⑤
[ ]11.某不纯的铁可能含有Mg、Al、Cu等金属杂质,取该铁的样品5.6 g,与足量的稀硫酸反应,得到标准状况下的氢气2.24 L,则下列分析的结论中正确的是
A.一定同时含有三种金属杂质 B.一定不含有杂质铜
C.一定含有杂质镁 D.可能含有镁、铝中一种或两种
[ ]12.铝和铍的性质十分相似.下列关于铍性质推断正确的是
A.铍能与强酸或强碱起反应 B.氢氧化铍可溶于水
C.氯化铍溶液显中性 D.氧化铍的化学式Be2O3
[ ]13.Fe3O4与某浓度的HNO3溶液反应生成Fe(NO3)3、NO和H2O,此时若有1 mol Fe3O4完全溶解,则被还原的硝酸是
A.9mol B.3mol C.1/2mol D.1/3mol
[ ]14.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
A.由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+
B.由Al、Cu、稀硫酸组成原电池,负极反应式为:Cu-2e-=Cu2+
C.由Al、Mg、NaOH溶液组成原电池,负极反应式为:Mg-2e-=Mg2+
D.由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-=Cu2+
[ ]15.由Mg、Cu、Fe、Al四种金属,若两两混合,取混合物26克与足量稀硫酸反应,产生标准状况下H2 11.2L,此混合物的可能组合的方式最多有
A 2种 B 3种 C 4种 D 5种
[ ]16.现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:实验设计1:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计2:铝镁合金 ![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计3:铝镁合金![]() 溶液
溶液![]() 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是
A.都能 B.都不能 C.①不能,其它都能 D.②③不能,①能
[ ]17.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为: Zn + 2 MnO2十H2O = ZnO + 2MnO (OH)2。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 + 2e一+ 2H2O = 2MnO (OH)2十2OH-
[ ]18.Mg、Al、Fe三种金属的混合物与足量的稀硫酸反应,生成2.80L H2(标准状况),则三种金属的物质的量之和不可能是
A.0.120mol B.0.150mol C.0.0900mol D.0.100mol
[ ]19.把一定量某碱金属与2.7g铝的混合物放入足量水中,金属全部溶解,收集到标准状况下的气体5.6L,向所得溶液中通入过量二氧化碳,过滤,把滤液低温减压蒸干得固体20g,则此碱金属的相对原子质量为
A 7 B 23 C 39 D 85
[ ]20.常温下,将V1 mL、c1 mol·L-1的氨水滴加到V2 mL、c2 mol·L-1的盐酸中,下列结论正确的是
A.若混合溶液的pH=7,则c1·V1>c2·V2 B.若V1=V2,c1=c2,则混合液中c(NH+4)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-) D.若V1=V2,且混合液的pH<7,则一定有c1<c2
[ ]21.铊 (Tl) 是某超导材料的组成元素之一,与铝同族,位于第六周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+ 。下列推断正确的是
A.Tl+的最外层有一个电子 B.Tl3+ 的氧化性比Al3+ 弱
C.Tl能形成+3价和+1价的化合物 D.Tl+ 的还原性比Ag强
[ ] 22.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
22.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2—2e-=2H+ D.该电池正极反应为O2+4e-=2O2-
[ ]23.有一氧化铁样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,亚铁离子全部转变为铁离子,则该氧化物可能的化学式为
A.Fe 2O 3 B. Fe 3O 4 C.Fe 4 O5 D.Fe 5O 7
[ ]24.将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于
 A.22.4bc×10-3
B.44.8bc×10-3
A.22.4bc×10-3
B.44.8bc×10-3
C.22.4(3a-4bc×10-3) D.22.4(3a-4bc)×10-3
[ ]25.以下物质间的相互转化关系中,A、B、C是常见的金属或非金属单质,D、
E、F是常见的三种氧化物,常温下,D、E呈气态,F呈固态;下列推断正确的是
A.A、B、C三种中一定没有一种是氧气 B.A一定是金属单质
C.单质B肯定是氧化剂 D.D、E中一定含有A的元素
[ ]26.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知: ①a、c均能与稀硫酸反应放出气体; ②b与d的硝酸盐反应,置换出单质d; ③c与强碱反应放出气体; ④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
[ ]27.要求设计实验证明: 某种盐的水解是吸热的,有四位同学分别作出如下回答,不正确的是:
A. 甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明盐类的水解是吸热的
C. 丙同学:通过实验发现同浓度的热的纯碱液比冷的纯碱液去油污效果好,说明碳酸钠水解是吸热的
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
28.在120 ℃时分别进行如下四个反应:
A.2H2S+O2 ==2H2O+2S B.2H2S+3O2 ==2H2O+2SO2
C.C2H4+3O2==2H2O+2CO2 D.C4H8+6O2==4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和 p前> p后的是_____ ;符合关系式d前=d后和 p前= p后的是______ (请填写反应的代号.下同)。
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和 V前<V后的是________;符合d前>d后和 V前>V后的是______ _
29.在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的是:
(填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的是
(2)现提供以下试剂: A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的.并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为 (填“可行”或“不可行”)
理由是:
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是
 写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
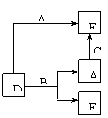
30.已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:(有部分物质省略)
写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
30.已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:(有部分物质省略)
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为
写出A+E→D的化学反应方程式 。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为______ ,
写出A+E→D的化学反应方程式 。
(3)若常温下B为气体,C为黑色固体,则金属A的原子结构示意图为 ,
写出A+E→D的化学反应方程式
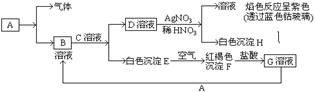 31.已知有以下物质相互转化
31.已知有以下物质相互转化
试回答:⑴ 写化学式B D
⑵ 写出由E转变成F的化学方程式
⑶ 写出用KSCN鉴别G溶液的离子方程式
向G溶液加入A的有关离子反应方程式
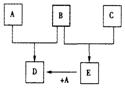
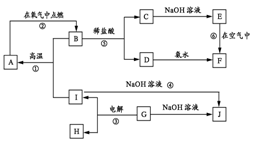 32.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。请填写下列空白:
32.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质B、F、G的化学式:B ,F G ,
(3)用文字表述如何用实验加以证明G是离子化合物还是共价化合物:
(4) 写出反应①、④的化学方程式:
反应①: 反应④:
33.某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释 (填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
反应的离子方程式为 。
⑶实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
34.将Cu与Fe2O3的混合粉末a g与1mol/L硫酸进行反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中无Fe3+,则
a= ,混合粉末中铜的质量为 。
(2)若将固体完全溶解于1.00L上述硫酸中,测得c(Fe3+)=0.1mol/L(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为 g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中既有Fe3+,也有Fe2+,则 a 的取
值范围是 。
参考答案
1D 2C 3A 4D 5B 6B 7B 8D 9C 10C 11D 12A 13D 14D 15C
16A 17D 18B 19C 20A 21C 22C 23D 24A 25D 26C 27A
28.(1)B; C (2)D; A
29。(1)Br2;Fe3+
| (2) 乙 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | C | 有机层无色 |
| 第二种方法 | D | 溶液变红 |
(3)不可以,因为Br2和Fe3+都能把I—氧化成I2
Fe2+; 2 Fe2+ + 4 Br- + 3Cl2 === 2 Fe3+ +2 Br2 + 6Cl-
30.(1) E:CuO,
H2+CuO![]() Cu+H2O。
Cu+H2O。
(2) E:![]() 3Fe+4H2O(g)
3Fe+4H2O(g) ![]() Fe3O4+4H2。
Fe3O4+4H2。
(3) A: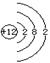 2Mg+CO2
2Mg+CO2![]() 2MgO+C。
2MgO+C。
31.⑴ FeCl2, KCl;
⑵ 4 Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3。
⑶ Fe3+ +3SCN -== Fe(SCN)3,2Fe3+ +Fe == 3Fe2+。
32.⑴Fe
⑵Fe3O4 Fe(OH)3 Al2O3
⑶看其熔融状态是否导电
⑷ 8Al+3Fe3O4 ![]() 4Al2O3+9Fe
2Al+2OH-+2H2O=2AlO2-+3H2↑
4Al2O3+9Fe
2Al+2OH-+2H2O=2AlO2-+3H2↑
33.⑴合理
⑵NaOH溶液 ![]() 2Al+2NaOH+H2O=2NaAlO2+3H2↑
2Al+2NaOH+H2O=2NaAlO2+3H2↑
⑶B
34.(1) 22.4 6.4g
(2)18.1 16<a<22.4