高二年级理科化学第一学期期末考试题
命题:陈婉英
审核:蔡景东
相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5
Na-23 Mg-23 Al-27 Fe-56 Cu-64
一、选择题(每小题只有一个正确答案,每小题2分,共44分)
1、32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
2、下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Al比Mg失去电子数多,所以Al比Mg的还原性强
D.O与S为同主族元素,且O比S的非金属性强
3、碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是
(A)①③② (B)②③① (C)③①② (D)②①③
4、下列各分子中所有原子都符合8电子结构的是
A.BeCl2
B.PCl3 C.PCl5 D.H2O
5、下列物质中,即含有离子键,又含有非极性共价键的是
A.Na2O2 B.NaOH C.Na2O D.MgCl2
6、用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B. V形;三角锥形
C.直线形;平面三角形 D. V形;平面三角形
7、将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯。下列说法错误的是
A.ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式
B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
![]() C.聚全氟乙丙烯分子的结构简式可能为
C.聚全氟乙丙烯分子的结构简式可能为
D.四氟乙烯中既含有极性键又含有非极性键
8、x、y为两元素的原子,x的阴离子与y的阳离子的电子层结构相同,
由此可知
A. x的原子半径大于y的原子半径
B. x的第一电离能小于y 的第一电离能
C. x的金属性大于y的金属性
D. x的电负性大于y的电负性
9、下列物质:①干冰,②石英,③白磷,④氯仿(CHCl3),⑤过氧化钠。
其中含极性键的非极性分子是
A.②③⑤ B.②③ C.① D.①③④
10、具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s23p3 B. 1s22s22p3 C.1s22s22p5 D. 1s22s22p63s23p4
11、NH4+离子的空间构型是
A. 平面正方形 B. 三角锥形 C.正四面体 D. 八面体
12、下列说法正确的是
A.Xm+和Yn—与氖的电子层结构相同,原子半径前者大于后者。
B.NaF和MgF2中阳离子与阴离子半径之比,前者小于后者。
C.![]() O和
O和![]() O原子的核外电子数,前者大于后者。
O原子的核外电子数,前者大于后者。
D.PH3和H2S的稳定性,前者大于后者。
13、在下列各组中,只要混合物的物质的量总和不变,按任意比混合,
完全燃烧所消耗的O2的总量不变的是
A.甲烷、甲醇、甲醛
B. 甲醇、乙醇、丙醇
C.乙炔、苯、乙烯基乙炔(CH2=CH-C≡CH)
D. 乙醇、乙烯、丙稀酸(CH2=CH-COOH)
14、根据电子排布的特点,Fe在周期表属于
A.s区 B.p区 C.d 区 D.ds区
15、下列图式表示正确的是
A.氟化氢的电子式: H:F
B.次氯酸的结构式: H-Cl-O
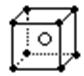
![]() C.铝离子的结构示意图
C.铝离子的结构示意图
D.氯化铯的晶体结构(晶胞)模型:
16、已知乙烯分子中碳原子以3个sp2杂化轨道与碳原子或氢原子形成σ键,两个碳原子上未参与杂化的p轨道形成π键。下列关于乙烯分子的叙述中正确的是
A.乙烯分子2个碳原子和4个氢原子不可能在同一个平面内
B.乙烯分子中键角约为109°28′,所有原子在同一个平面内
C.乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小
D.乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应
17、设NA为阿佛加德罗常数,下列说法不正确的是
A.标准状况下,22.4 L氦气中含2NA个氦原子
B. 18g水中含有的电子数为10NA
C.1mol Cl2与金属Na完全反应,可以得到2NA个电子
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
18、下列各组物质的相互关系正确的是( )
A.同位素:1H 、2H、3H、H2
B.同素异形体:C60、C70、金刚石
 C.同系物:C2H4、C3H6、C4H8
C.同系物:C2H4、C3H6、C4H8
 D.同分异构体:
D.同分异构体:
19、关于原子轨道的说法正确的是( )
A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体.
B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的;
C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道;
D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键.
20、据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为
HC≡C—C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是:
A. 晶体的硬度与金刚石相当 B. 能使酸性高锰酸钾溶液褪色
C. 不能发生加成反应 D. 不能使溴水褪色
21、下列物质在催化剂作用下和氢气加成不能得到2-甲基戊烷的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
22、CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料与干冰都属于纯净物
D.聚二氧化碳塑料的使用会产生白色污染
高二化学试题
选择题答题卡
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|
| 题序 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
成绩
二、填空题(共30分)
23(5分)、下表为元素周期表前三周期的一部分。
| X | Z | ||
| W | Y | R | |
| |||||||||||||
| X | Z | ||
| W | Y | R | |
| X | Z | ||
| W | Y | R | |
(1)X的氢化物的沸点与W的氢化物的沸点比较: > _______ (填化学式),原因是 。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式 _ ,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合 。(填序号)。
| |||||||||
| |||||||||
A. B.
C.泡利原理 D.洪特规则
(3)以上五种元素中, 元素原子失去核外第一个电子需要的能量最多(填元素符号)。
24(5分)、氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。
(1)根据性质,推测氮化硅属于________晶体。
(2)根据性质,推测氮化硅陶瓷的用途是_________(填序号)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(3)根据化合价规律,推测氮化硅的化学式为_________。
(4)氮化硅陶瓷抗腐蚀性强,除氢氟酸外,它不与其他无机酸反应。试写出该陶瓷被氢氟酸腐蚀的化学方程式
_________________________________________________。
(5)现用四氯化硅和氮气在氢气保护下加强热反应,可得较高纯度的氮化硅,反应的化学方程式为__________________________________。
25、(12分)有W、X、Y、Z四种原子序数依次增大的元素。已知:
①W与X或Y形成的化合物的焰色反应均呈黄色
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数3
④Z可与Y组成化合物ZY2和ZY3
请回答:
(1)Z元素在元素周期表中的位置是第 周期 族
(2)W2X的电子式为 。
(3)写出工业上电解饱和WY溶液的化学方程式:
。
当电极上通过0.1mol电子时,阴极生成的气体是 ,其物质的量为 。
(4)鉴别ZY3 溶液和ZY2溶液的方法是:
_______________________________________________________ (用化学方程式表示)
(5)在氧气中燃烧4g X单质生成一种有刺激性气味的气体,同时放出a kJ热量,写出该反应的热化学方程式
。
26、(8分)现有甲、乙、丙、丁四种晶胞(如下图所示),可推知:甲晶体中A与B的离子个数比为 _______________ ;乙晶体的化学式为 __________ ;丙晶体的化学式为_________________;丁晶体的化学式为________________________。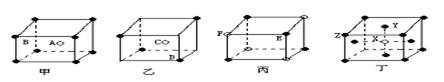
三、(本题 共19分)
27(2分)、4-甲基-2-乙基-1-戊烯经催化加成所得产物名称为
28(3分)、按要求完成下列问题
(1)甲基的电子式________ _____
(2)通式为CnH2n+2的最简单同系物的分子式
(3) CH2 =CHCH=CH2的键线式
29(6分)、写出下列反应的化学方程式(有机物要求用结构简式表示)
1)乙烯和水在催化剂存在下加成
________________
2)乙烯加聚
3)异戊二烯(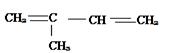 )利用1,4-加成反应进行加聚
)利用1,4-加成反应进行加聚
30、已知下列有机物(8分)
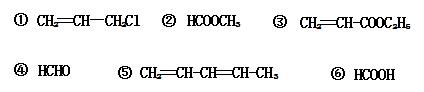
请回答问题(填写序号):
属于烃的是 ;属于羧酸的是 ;
属于酯的是 ;属于醛的是 。
四、计算题
31、(7分)某烃中C、H的质量比为6:1,其蒸气对氢气的相对密度28,且该有机物常温下能使酸性高锰酸钾溶液褪色,请通过计算写出该有机物的分子式,并写出其符合题意的所有同分异构体(不考虑立体异构)。
化学试题
参考答案
| 题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | C | A | B | A | D | C | D | C | A | C |
| 题序 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | A | C | C | D | D | A | B | C | B | A | A |
23、(1)NH3>PH3; 氨分子间不仅存在范德华力还存在氢键,PH3分子间只有范德华力而没有氢键. (2)B、D;(3)Ar
24、(1)原子晶体 (2)A、C、D (3)![]()
(4)![]()
![]() (5)
(5)![]() (或
(或
25、 (1)第四周期第Ⅷ族(2)
(3)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑, 氢气, 0.05mol
2NaOH+H2↑+Cl2↑, 氢气, 0.05mol
(4) (5)S(s)+O2(g)=SO2(g);ΔH=-8akJ/mol
26、 1:1; C2D; EF; XY2Z
![]() 27、 D.2,4-二甲基己烷
27、 D.2,4-二甲基己烷
28、(1)略 (2)CH4, (3)
![]() 29、 CH2=CH2 +
H2O
CH3CH2OH
29、 CH2=CH2 +
H2O
CH3CH2OH
30、5; 6; 2、3; 4
31. C4H8 三种