高二年级秋学期期末考试试题
化学试题
考试时间:90分钟 试题满分:100分+10分
说明:
1.可能用到的相对原子质量:H-1,O-16,S-32,Cl-35.5,Cu-64,Fe-56,N-14,C-12,Na-23
2.重点中学的同学和普通中学重点班的同学附加题必须做,其他同学附加题可以不做。
第Ⅰ卷(选择题 共54分)
一、选择题(每小题只有一个正确答案,每小题3分,共54分)
1.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NOx等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是此项研究的重要应用之一。下列有关说法不正确的是
A.CO在铂表面被氧化生成CO2,铂起催化作用
B.汽车尾气中NOx在铂表面发生反应的产物是N2
C.CO在铂表面可能和O2、NOx反应
D.NOx、CO、CO2均能与人体中的血红蛋白结合
2.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
![]() A.氢硫酸的电离方程式:H2S+H2O=H3O++HS- B.Na2S的电子式:
A.氢硫酸的电离方程式:H2S+H2O=H3O++HS- B.Na2S的电子式:
![]() C.NH4Cl的电子式为:
C.NH4Cl的电子式为: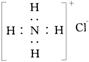 D.丙烷的分子结构模型示意图:
D.丙烷的分子结构模型示意图:
3.PH相同的盐酸和醋酸两种溶液中,它们的
A.H+的物质的量相同 B.物质的量浓度相同
C.H+的物质的量浓度不同 D.H+的物质的量浓度相同
4.叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质,3mol NaN3受撞击会生成4mol 氮气和一种离子化合物(Na3N)。下列有关叙述错误的是
A.NaN3受撞击时,NaN3既是氧化剂又是还原剂
B.叠氮酸(HN3)分子中各原子都满足于8个电子稳定结构
C.Na3N中N3-半径比Na+半径大
D.NaN3中,既存在离子键又存在非极性共价键
5.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
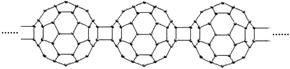
A.X难溶于水 B.一定条件下X可与H2发生加成反应
C.X是碳的一种同素异形体 D.X的摩尔质量为720n
6.下图分别表示四种操作,其中有两处错误的是
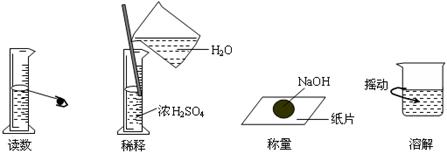
A B C D
7.对下列各种溶液中所含离子的判断合理的是
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42—,Br—,OH—,Ba2+
B.在c(H+)=10—14mol/L的溶液中可能含:Na+,AlO2—,CO32—,SO32—
C.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3—
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3—
8.能正确表示下列反应的离子方程式是
A.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2—+4H+ Al3++2H2O
B.石灰水与足量碳酸氢钠溶液反应:HCO3—+Ca2++OH— CaCO3↓+H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:
2H++SO42—+Ba2++2OH— BaSO4↓+2H2O
D.FeSO4溶液中加H2O2:2Fe2+ + H2O2+ H+ = 2Fe3+ +2H2O
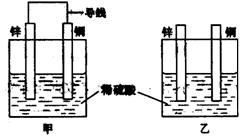 9.关于如图所示装置的叙述,正确的是
9.关于如图所示装置的叙述,正确的是
A.两装置中锌片都发生氧化反应
B.两装置中溶液的pH均减小
C.两装置中铜片的质量均逐渐减小
D.两装置中铜片表面均无气泡产生
 10.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
10.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如右图,其中R1、R2为烷烃基。则下列有关始祖鸟烯的说法中正确的是
A.始祖鸟烯与乙烯互为同系物
B.若R1=R2=CH3,则其化学式为C12H16
C.若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种
D.始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,
其褪色原理是一样的
11.1mol气态烃A最多和2mol HCl加成,生成氯代烷B,1mol B与6mol Cl2发生取代反应,生成只含碳、氯两种元素的化合物。则A的分子式为
A.C2H2 B.C3H4 C.C3H6 D.C4H6
12.桶烯(Barrelene)结构简式如右图所示,有关说法不正确的是
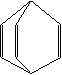 A.桶烯分子中所有的原子在同一平面内
A.桶烯分子中所有的原子在同一平面内
B.桶烯在一定条件下能发生加聚反应
C.桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体
D.桶烯中的一个氢原子被氯原子取代,所得产物只有两种
13.已知共轭二烯烃(两个碳碳双键间有一个碳碳单键)与烯烃或炔烃可发生反应生成六元环状化合物。如:1,3 ─丁二烯与乙烯反应可表示为:
则异戊二烯(2 ─甲基─1,3 ─丁二烯)与丙炔反应,生成产物的结构简式可能是
14.用物质的量都是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是
A.c(H+)<c(OH-) B.c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1
C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1mol·L-1
15.下列操作中,能使电离平衡 H2O![]() H++OH– 向右移动且溶液呈酸性的是
H++OH– 向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
16.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
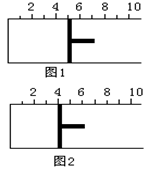 17.如右图所示,一定条件下将1mol A2气体和3molB2气体充入一
17.如右图所示,一定条件下将1mol A2气体和3molB2气体充入一
容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在
![]() 恒温恒压下发生如下反应:A2(g)+3B2(g)2AB3(g)
恒温恒压下发生如下反应:A2(g)+3B2(g)2AB3(g)
。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是
A.20% B.60% C.40% D.无法确定
18.某密闭容器中进行如下反应:X(g)+2Y(g) ![]() 2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足:
2Z(g),若要使平衡时反应物总物质的量与生成物的物质的量相等,且用X、Y作反应物,则X、Y的初始物质的量之比的范围应满足:
A.1<X/Y<3; B.1/4<X/Y<2/3
C.3< X/Y <4; D.1/4< X/Y <3/2
第Ⅱ卷(非选择题 共46分)
二.实验题(本大题包含两小题,共12分):
19.I.(2分)下列实验操作或对实验事实的叙述正确的是___________(填序号)
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④配制Al2(SO4)3溶液时,加入少量的稀硫酸;
⑤将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的pH;
⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液。
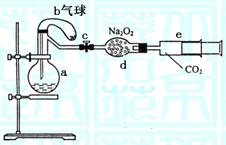 II.(10分)下图所示装置中,a是盛有标况下224 mL空气 (氧气占五分之一)和10 mL 1.2 mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
II.(10分)下图所示装置中,a是盛有标况下224 mL空气 (氧气占五分之一)和10 mL 1.2 mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反 应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是_________。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施,若用加入化学试剂法,下列试剂中可以使用的是(填代号)________________________。
A.蒸馏水 B.无水醋酸钠 C.石墨 D.硝酸银(少量)
(3)将烧瓶充分振荡,所观察到的现象是____________________________;有关反应的化学方程式__________________________________________________。
(4)打开弹簧夹c,将二氧化碳推入干燥管内,使反应充分进行。将烧瓶中反应的全过程用一个总的化学方程式表示:_______________________________________。
(5)欲使所有的铜粉都溶解,至少需要推入二氧化碳_________mL(设推入的二氧化碳全部反应)。
三.推断题(7分):
20.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。试推断:
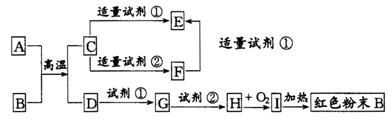
(1)(3分)写出物质的化学式:A:_______ C:________ I:________
(2)(4分)写出下列反应的方程式:
C→F的离子方程式
H→I的化学方程式
四.填空题(本大题包含两小题,共27分)
21.(8分)常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)(2分)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)(1分)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(3)(1分)取适量溶液④,加入少量氯化铵固体,此时溶液中![]() 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)(2分)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(5)(2分)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的
c(H+)= mol·L-1
22.(9分)(1)(3分)高铁电池是一种新型可充电电池,与普通电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
![]() 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请写出:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请写出:
①放电时负极的反应式 。
②放电时正极附近溶液的碱性 (填增强、减弱或不变)
(2)(6分)剪约6cm长,2cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“-”端相连结,电流表指针调到中间位置,取50mL两只小烧杯,在一只烧杯中注入40mL浓HNO3,另一只烧杯中注入40mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为 。
②两电极同时插入浓HNO3中,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为 。
23.(10分)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g) + 3H2
(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应达平衡前某时刻t时,n(N2)=13mol,n (NH3)=6mol,则a=________mol。
(2)反应达平衡时,若混合气体的体积为716.8L(已换算为标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为__________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)
n(起始):n(平衡)= ;原混合气体中,a:b=
(4)达到平衡时,N2和H2的转化率之比,![]() (N2) :
(N2) : ![]() (H2) =
(H2) =
五.附加题(共10分)
24.(10分)乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=_________。
(2)当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
(3)a的取值范围是____________________________。
(4)b的取值范围是____________________________。
化学试题参考答案和评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | D | D | B | D | B | B | C | A |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | B | A | B | B | B | A | C | D |
19.I.(2分)④⑥
II.(10分)
(1)溶液逐渐变蓝,烧瓶中气体逐渐变为红棕色,气球变大 (2分)
(2)C D (2分)
(3)气球体积变小,瓶内气体颜色变浅 3NO2+H2O=2HNO3+NO (2分)
(4)2Cu+4HNO3+O2=2Cu(NO3)2+2H2O (2分)
(5)44.8 (2分)
20.(共7分)(1)(每空1分,共3分)A: Al; C:Al2O3; I:Fe(OH)3
(2)(4分)Al2O3+2OH-=2AlO2-+H2O;
4Fe(OH)2+O2+2H2O 4Fe(OH)3(每空2分)
21.(共8分,)
(1)(2分)①② ① (2)(1分)②
(3)(1分)减小 (4)(2分)c(C1-)>c(NH4+)>c(H+)>c(OH-)
(5)(2分)10-12mol·L-1
22.(9分)(1) Zn-2e-+2OH-=Zn(OH)2 (2分); 增强(1分)
(2)铝 (1分); A1-3e-=A13+ (2分);
Cu (1分) NO3-+e-+2H+=NO2+H2O(2分)
23.(每空2分,共10分) (1)a=16 (2) 8mol (3) 5:4 2:3 (4) 1:2
24.(每空2分,共10分)(1)1:1 (2)3, 1:3
(3)![]() <a<
<a<![]() (4)
(4)![]() <b<
<b<![]()