高二必修化学上学期期末考试试卷
本卷可能用到的相对原子质量 H:1 C:12 O:16 Cu:64
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本大题17题,每题3分,共51分)
1.α粒子是一种仅有两个质子和两个中子组成的微粒。下列关于α粒子的说法正确( )
A.呈电中性 B.带2个单位正电荷
C.带4个单位正电荷 D.质量数为2
2.下列物质属于有机物的是 ( )
A.碳酸钙 B.一氧化碳
C.乙酸 D.双氧水
3.下列气体不能用碱石灰(氢氧化钠固体和生石灰的混合物)干燥的是 ( )
A.CO2 B.H2 C.NH3 D.CO
4.某溶液中滴入KSCN溶液后变红,说明该溶液中存在 ( )
A.Fe2+ B.Fe3+ C.Mg2+ D.K+
5.常温下,下列各组物质反应时能产生氢气的是 ( )
A.铁和浓硫酸 B.铜和稀硫酸
C.锌和稀盐酸 D.铁和浓硝酸
6.下列物质属于共价化合物的是 ( )
A.H2SO4 B.KOH C.NaHCO3 D.CaO
7.下列反应中,水作为氧化剂的是 ( )
A.NaOH+HCl=NaCl+H2O B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.Cl2+H2O=HCl+HClO
8.下列离子在溶液中可以大量共存的一组是 ( )
A.Al3+、Cl-、OH- B.K+、OH-、HCO3-
C.Na+、NO3-、Cl- D.Ca2+、Cl-、CO32-
9.下列关于乙烯的说法中错误的是 ( )
A.能使酸性高锰酸钾溶液褪色 B.分子中6个原子都在同一平面上
C.分子中C、H元素的质量比为2∶1 D.可以和溴发生加成反应
10.下列说法错误的是 ( )
A.碳酸钙受热分解是吸热反应 B.燃料的燃烧反应都是放热反应
C.升高温度可以加快反应速率 D.乙烷、乙烯、乙炔三者互为同素异形体
11.下列物质不能用来鉴别氯化钠溶液和碳酸钠溶液的是 ( )
A.酚酞试液 B.硝酸钾溶液 C.氯化钙溶液 D.稀硫酸
12.下列离子方程式中,正确的是 ( )
A.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.盐酸和氢氧化铝反应: H++OH-=H2O
C.盐酸和碳酸钙反应:2H++CO32-=H2O+CO2↑
D.氯化钠溶液与硝酸银溶液反应:Cl-+Ag+=AgCl↓
13.为了减少酸雨的产生,下列措施中合理的是 ( )
A.大量使用原煤作燃料 B.把工厂烟囱造高
C.化石燃料脱硫 D.禁止使用各种化石燃料
14.下列物质中能使湿润的淀粉碘化钾试纸变蓝的是 ( )
A.硝酸钠溶液 B.碳酸钾溶液 C.氯水 D.氯化钠溶液
15.既可以用向上排空气法收集又可以用排水法收集的气体是 ( )
A.H2 B.O2 C.NH3 D.NO2
16.下列物质不能使品红溶液褪色的是 ( )
A.氯气 B.二氧化硫 C.漂白粉 D.氨气
17.欲将含有Mg2+、Al3+的混合溶液中的Mg2+沉淀下来,下列措施可行的是 ( )
A.向混合溶液中加入过量的铝粉
B.向混合溶液中加入过量的盐酸
C.向混合溶液中加入过量的氨水
D.向混合溶液中加入过量的氢氧化钠溶液
二、单项选择题:本大题为《化学与生活》,共6题,每题3分,共18分)
18.下列物质中目前尚未被我国列入空气质量报告的是 ( )
A.二氧化氮 B.二氧化硫 C.二氧化碳 D.可吸入颗粒物
19.黄铜是生活中比较常见的一种合金,构成它的主要元素是 ( )
A.铜和锌 B.铜和锡 C.铜和镍 D.铜和碳
20.下列离子会造成水体污染的是 ( )
A.CO32- B.Cu2+ C.Cl- D.Na+
21.下列元素中属于人体生命活动必需微量元素的是 ( )
A.C B.Cl C.Na D.Zn
22.下列纤维的主要成份是蛋白质的是 ( )
A.棉花 B.蚕丝 C.尼龙 D.人造羊毛
23.下列举措不能防止或减缓钢铁腐蚀的是 ( )
A.在钢铁制品表面镀一层金属锌
B.将钢铁制品放置在潮湿处
C.在钢铁中加入锰、铬等金属,以改变钢铁结构
D.将钢铁制品与电源负极相连
三、本大题包括2题,共10分。此大题供选学《化学与生活》模块的考生答。
24.(5分)细菌的繁殖需要核酸,核酸的合成需要二氢叶酸。在二氢叶酸的合成过程中,对氨基苯甲酸是一种极其关键的物质,其结构简式为![]() 。
。
(1)它的分子式是 ;官能团-COOH的名称是 ;
(2)在它的水溶液中滴入紫色石蕊试液,溶液颜色变红,说明它的溶液具有 性;
(3)在其水溶液中加入碳酸钠溶液会产生大量气体,产生该气体的化学方程式是(用
R-COOH表示对氨基苯甲酸) ;
(4)对氨基苯甲酸可以和另一种氨基酸反应生成一种二肽(其结构为
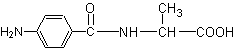 ),则另一种氨基酸的结构简式为 。
),则另一种氨基酸的结构简式为 。
25.(5分)(1)由光导纤维组成的光缆可以代替通讯电缆,用于光纤通信,传送高强度的激光。光导纤维主要成份的化学式是 。
(2)氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上曾普遍采用高纯硅和纯氮在1300℃时反应获得氮化硅,试写出该反应的化学方程式: ;现在主要是利用四氯化硅、氮气和氢气在强热条件下反应来获得高纯氮化硅,请写出该反应的化学方程式: 。
四、本大题3题,共21分。
26.(5分)某同学欲配制250 mL 2 mol·L-1 的碳酸钠溶液,并进行有关实验。请回答下列问题:
(1)需称量无水碳酸钠的质量 g。
(2)配制该碳酸钠溶液时使用的仪器除天平(带砝码)、烧杯、玻璃棒外,还必须 用到的仪器有 、 等。
(3)取所配制的碳酸钠溶液125 mL,向其加入125 mL 3mol·L-1 的硫酸溶液,待充分反应后,生成的气体在标准状况下所占的体积为(假设产生的气体全部逸出) ;设反应后溶液的体积为250mL,则反应后溶液中Na+的物质的量浓度为 。
 27.(6分)今有中学化学常见的五种物质,他们在一定条件下有如图所示的转化关系。写出一个符合下列条件的反应Ⅰ的化学方程式。
27.(6分)今有中学化学常见的五种物质,他们在一定条件下有如图所示的转化关系。写出一个符合下列条件的反应Ⅰ的化学方程式。
(1)若A为金属单质,B为非金属单质:
;
(2)若A和B均为金属单质:
;
(3)若A为化合物,B为金属单质:
。
28.(10分)某同学将一小片铜块投入足量的浓硝酸后,再将生成的气体A通过水洗得到标准状况下11.2L的气体B。
(1)气体B的化学式是 ;
(2)将铜片投入浓硝酸中可观察到的现象是溶液由无色变成 色,同时生成 色的气体;
(3)通过计算求出铜片的质量。
高中期末考试评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | A | B | C | A | B | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | D | B | D | C | C | B | D | D |
| 题号 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | C | A | B | D | B | B |
三、
24.(5分)
(1)C7H7O2N 羧基 (2)酸
(3)R-COOH+Na2CO3=R-COONa+H2O+CO2↑
(4)![]()
25.(5分)(1)SiO2
(2)3Si+2N2
 Si3N4
Si3N4
3SiCl4+2N2+6H2![]() Si3N4+12HCl
Si3N4+12HCl
四、本大题3题,共21分。
26.(5分)(1) 5.3 (2) 容量瓶(250mL) 、 胶头滴管
(3) 5.6L 、2 mol·L-1
27.(6分)(1)2Na+2H2O=2NaOH+H2↑
(或2Mg+CO2 ![]() 2MgO+C 或Fe+H2O
2MgO+C 或Fe+H2O ![]() Fe3O4+H2↑)
Fe3O4+H2↑)
(2)8Al+3Fe3O4![]() 9Fe+4Al2O3
9Fe+4Al2O3
(3)CO+CuO![]() Cu+CO2
Cu+CO2
28.(10分)(1) NO(2分) (2)蓝 红棕色(各2分)
(3)(4分)48g