高二化学选修4过关检测试题
时间:100分钟 分值:120分
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。第一卷从第1页至第3页,第二卷从第5页至第8页。考试结束后,将第一卷答题卡和第二卷答题纸一并交监考老师。
第一卷(选择题 共56分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.在AgCl悬浊液中加入KI溶液充分振荡 Ag+ + I- = AgI↓
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为: Cu2++2e- == Cu
D.钢铁发生电化腐蚀的正极反应式:Fe -2e- == Fe2+
2.常温时,将两种溶液等体积混合,其中溶液pH一定或可能等于7的情况共有
①pH=2盐酸和pH=12 NaOH溶液 ②pH=2醋酸和pH=12 NaOH溶液
③pH=2盐酸和pH=12氨水 ④pH=2某酸和pH=12 NaOH溶液
⑤pH=2盐酸和pH=12某碱溶液 ⑥pH=2硫酸和pH=12 NaOH溶液
⑦pH=2盐酸和pH=12 Ba(OH)2溶液 ⑧pH=2硫酸和pH=12 Ba(OH)2溶液
A.5种 B.6种 C.7种 D.8种
3.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+)=10—13mol/L的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
4.物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是
A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>HY>HX
B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
C.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X-
D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-)
5.一定温度下,将a mol
PCl5通入一个容积不变的密闭容器中,发生反应: PCl5(g)
![]() PCl3(g)+Cl2(g),平衡时测得混合气体的压强为p1,此时向容器中再通入a
mol PCl5,在相同温度下再次达到平衡时,测得压强为p2,下列判断正确的是
PCl3(g)+Cl2(g),平衡时测得混合气体的压强为p1,此时向容器中再通入a
mol PCl5,在相同温度下再次达到平衡时,测得压强为p2,下列判断正确的是
A.2p1>p2 B.PCl5的分解率增大 C.p1>p2 D.Cl2的体积分数增大
![]() 6.对于可逆反应:2A(g)+B(g) 2C(g)
△H<0,下列各图中正确的是
6.对于可逆反应:2A(g)+B(g) 2C(g)
△H<0,下列各图中正确的是
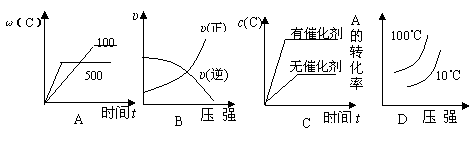 |
7.25℃时,pH=2的HCl溶液中,由水电离出的H+的浓度是
A.1×10-7mol·L-1 B.1×10-12mol·L-1 C.1×10-2mol·L-1 D.1×10-14mol·L-1
8.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4 +Na2CO3 主要:Cu2+ + CO32─ + H2O == Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─== CuCO3↓
(2)CuSO4 +Na2S 主要:Cu2+ + S2─== CuS↓
次要:Cu2+ + S2─+ 2H2O == Cu(OH)2↓+ H2S↑
下列几种物质的溶解度大小的比较中,正确的是
A、Cu(OH)2>CuCO3>CuS B、CuS >Cu(OH)2>CuCO3
C、CuS <Cu(OH)2<CuCO3 D、Cu(OH)2<CuCO3<CuS
二、选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.龋齿是影响人类口腔健康的重要原因,在牙膏中加入适量的氟化物可以防止龋齿。下列关于氟化物防治龋齿的化学原理以及牙膏中加氟的观点正确的是
A.牙膏中的氟含量越多越能保障人体健康
B.F-能使牙齿矿物质转化为溶度积更小的物质而更能抵御酸的侵蚀
C.含氟牙膏适宜于所有人群
D.F-能抑制口腔细菌产酸
10.已知在等温条件下,化学反应方向的判据为:△H-T△S<0反应能正向自发进行;△H-T△S=O 反应达平衡状态;△H-T△S 反应能逆向自发进行(其中△H为焓变,△S为熵变,T为热力学温标,单位为K)
设反应A(s)==D(g)+E(g) △H-T△S=(-4500+11T)J/mol要防止反应发生,温度必须
A、高于400K B、低于136K
C、高于136K而且低于409K D、低于409K
11.目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的
β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx![]() 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是
A、放电时,Na 作正极,S极发生还原反应
B、充电时钠极与外电源的正极相连
C、当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠2.3g
D、充电时,阳极发生的反应为:Sx2--2e-=xS
12.已知金刚石和石墨在氧气中完全燃烧的热化学方程式为:
① C(金刚石、s)+O2(g)==CO2(g) △H1=-395.41kJ/mol
② C(石墨、s)+O2(g)==CO2(g) △H2=-393.51kJ/mol
关于金刚石与石墨的转化,下列说法正确的是
A.金刚石转化成石墨是自发进行的过程 B.石墨转化成金刚石是自发进行的过程
C.石墨比金刚石能量低 D.金刚石比石墨能量低
13.对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是:
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d
B.若从正反应开始,平衡时,A、B的转化率相等,则A、B的物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为M+bmol,则a+b=c+d
D.若a+b=c+d ,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变。
14.化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是
A.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7;SO42- + 2H+ + Ba2+ + 2OH- = BaSO4↓ + 2H2O B.明矾水解的离子方程式: Al3++3 H2O===Al(OH)3 ↓+3H+
C.Mg(HCO3)2 溶液与盐酸溶液反应的离子方程式:HCO3-+ H+ == CO2↑+H2O
D.常温常压下,1g氢气充分燃烧生成液态水,放出142.9 kJ热量。
则表示氢气燃烧热化学方程式2H2(g)+O2(g)=2H2O(l) △H=+571.6kJ/mol
![]() 15.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
15.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
A.NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) B.NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
C.Na2A: c(Na+)>c(A2-)>c(OH-)>c(H+) D.H2A: c(H+)=c(HA-)+2 c(A2-)+c(OH-)
16.在373K 时,把0.5 mol N2O4气体通入体积为5 L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
A.前2 s,N2O4的平均反应速率为0.01 mol·L-1·s-1 B.平衡时,N2O4的转化率为60%
C.平衡时,体系内含NO2 为0.04 mol·L-1 D.在2 s时,体系内压强为反应前的1.1倍
第Ⅱ卷(共64分)
三、(本题包括2小题,共20分)


 17.(8分)(1)(6分)右图分别是温度计、量筒、滴定管的一部分,则:量筒应该是 读数为
mL
17.(8分)(1)(6分)右图分别是温度计、量筒、滴定管的一部分,则:量筒应该是 读数为
mL
滴定管应该是 ,读数为 mL
温度计应该是 ,读数是 ℃
(2)(2分)用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,
下列实验操作会引起测量结果偏高的是 。
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失
③中和滴定时,锥形瓶内有少量蒸馏水。
④酸式滴定管用蒸馏水洗后,未用标准液洗。
⑤读取滴定管终点读数时,仰视刻度线。
18.(12分)乙二酸俗名草酸,下面是甲、乙两个化学学习小组的同学对草酸晶体(H2C2O4·xH2O)和草酸(H2C2O4)分别进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
 Ⅰ.甲组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
Ⅰ.甲组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
甲组的同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
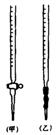
⑴ 滴定时,将KMnO4标准液装在右图中的 (填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是 。
⑶ 通过上述数据,求得x= 。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
Ⅱ.乙组同学的研究课题是:探究草酸(H2C2O4)受热分解的产物。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,在175℃以上开始分解。他们猜想分解产物中的气体可能是CO、CO2或它们的混合物。
乙组的同学利用下图所示装置进行“猜想”的实验探究。已知:A、C、F中盛装澄清石灰水,B中盛装浓NaOH溶液,D中装有碱石灰,E中装有CuO。
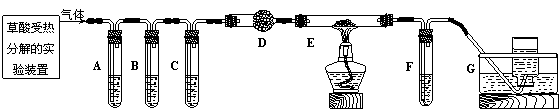
⑴ 证明分解产物中有CO2的现象是 ;证明分解产物中有CO的现象是 。
⑵ 讨论:小李同学继续查阅相关资料发现:草酸是二元弱酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。小李通过进一步研究,对实验中CO2的检验提出质疑。试根据相关信息,指出原设计中存在的问题,并提出实验的改进措施。 。
四、(本题包括3小题,共20分)
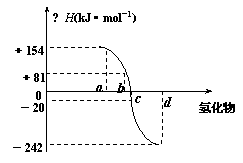 19.(6分)(1)已知:在298K、1.01×105Pa下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
19.(6分)(1)已知:在298K、1.01×105Pa下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。右图为氧族元素氢化物a、b、c、d的生成热数据示意图。试回答下列问题:
⑴写出氧族元素中含有18e-的两种氢化物的电子式 ; 。
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系 。
⑶硒化氢在上述条件下发生分解反应的热化学反应方程式为:
。
20.(8分)在537℃时,往容积可变的密闭容器中充入2molSO2(g)、1molO2(g),此时容器的体积为200L,压强为1.01×105Pa。向容器中加入固体催化剂,并保持恒温恒压,发生反应:2SO2+O2
![]() 2SO3,达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
2SO3,达到平衡时,平衡气体中SO3的体积分数为0.91。试回答下列问题:
(1)从理论上看,压强增大,平衡向正反应方向移动,SO2的转化率增大。但工业上二氧化硫催化氧化采用常压而不用高压,主要的原因是 。
(2)保持上述温度和压强不变,若向容器中只充入2molSO3,并加入固体催化剂,则平衡时SO2的体积分数是 ,此时平衡混合气体的体积是 。
(3)温度仍保持537℃,容器的体积保持200L不变。充入amol SO2和bmolO2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a:b=2:1,则a= 。
21.(6分)(1)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4种离子:X+、![]() 、H+、OH-下列分析结果肯定错误的是( )。
、H+、OH-下列分析结果肯定错误的是( )。
A.CY->CX+>CH+>COH- B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是( )
A.C![]() <CNa+
B.C
<CNa+
B.C![]() > C
> C![]()
C.2CH+= C![]() -C
-C![]() D.C
D.C![]() + C
+ C![]() =0.01mol·L-1
=0.01mol·L-1
五、(本题包括3小题,共18分)
22.(4分)工业上制取CuCl2的生产流程如下:
|
|
|
|
|
|

请结合下表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴ 向含有等浓度Fe2+、Cu2+、Fe3+的混合溶液中滴加NaOH溶液,最先生成的沉淀是 。
⑵ 溶液A中加入NaClO的目的是 。
⑶ 在溶液B中加入CuO后过滤,这次过滤控制的条件是 。
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
23.(7分)在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2
mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g);ΔH>0
CO2(g)+H2(g);ΔH>0
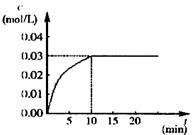 反应中CO2的浓度随时间变化情况如下图:
反应中CO2的浓度随时间变化情况如下图:
(1) 根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=_ __mol/(L·min);反应达平衡时,c(H2)=______________ mol/L,该温度下的平衡常数K= 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3) 如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=________________mol/L。
24.(7分) 已知:物质A的焰色反应呈黄色;物质G是一种白色物质,微溶于水;D、E为两种气体单质;M是一种合成树脂,常用于制备塑料和合成纤维。根据下面框图回答:
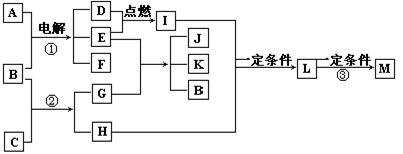
(1)物质C的电子式是 。
(2)写出下列反应的化学方程式:
反应① 。
反应② 。
反应③ 。
五、(本题包括1小题,共6分)
24.常温下,FeS的Ksp=6.25×10-18(设饱和溶液的密度为1g/mL)。若已知H2S饱和溶液在常温下,c(H+)与c(S2-)之间存在以下关系:c2(H+)·c(S2-)=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe 2+)达到1mol/L,应调节溶液的pH为多少?
高二化学苏教版选修4过关检测试题
参考答案及评分标准
一、选择题(本题包括8小题,每小题3分,共24分)
1.C 2.B 3.B 4.B 5.A 6.A 7.B 8.C
二、选择题(本题包括8小题,每小题4分,共32分)
9.BD 10.A 11.D 12.AC 13.BC 14.B D 15.AB 16.BD
三、(本题包括2小题,共20分)
17.(8分)(1)②、2.6; ③、1.30;①、2.5(每小题2分,错一格即得0分)
(2)②④⑤ (错一个,扣1分,扣完为止)
18.(12分,除指明分值的外每空1分)
Ⅰ(1)甲 (2)最后一滴高锰酸钾滴入溶液突然出现紫色,且半分钟内不褪色(2分)
(3)2 ①偏大 ②偏小
Ⅱ ⑴ 装置A中澄清石灰水变浑浊 (2分) 装置C中澄清石灰水不变浑浊,装置E中黑色氧化铜变为红色固体,装置F中澄清石灰水变浑浊 (2分) ⑵ 在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成了草酸钙沉淀,对实验有干扰,因而在装置A之前可增加一个装有水的洗气装置 (2分)
四、(本题包括3小题,共26分)
19.(5分)⑴![]() (2分)
(2分)
⑵非金属元素氢化物越稳定,△H越小,反之亦然 (2分)
⑶H2Se(g)=Se(s)+H2(g) △H=+81kJ·mol-1 (2分)
20.(8分)(1)常压下,SO2的转化率已达到近94%,增大压强,提高的转化率有限,而对动力和设备的要求提高,不利于经济效益的增加。(2)6% ;137L (3)2.91 (各2分,共8分)
21.(7分) (1)① 11 (2分)② 12 (2分)
(2)① C (2分)② D (2分)
五、(本题包括2小题,共18分)
22.(8分) ⑴ Fe(OH)3 (2分) ⑵ 将Fe2+氧化为Fe3+而使分离更加完全 (2分)
⑶ 溶液的pH为3~4 (2分) ⑷ 抑制Cu2+的水解(2分)
23.(10分) (1)0.003 0.03 9 (2)①③ (3)0.01(每空2分,共10分)
24.(1)![]()
![]() (2)①2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(2)①2NaCl+2H2O 2NaOH+H2↑+Cl2↑
②CaC2+2H2O→CH≡CH↑+Ca(OH)2
③![]()
五、(本题包括1小题,共6分)
25. 2.4
江苏省扬中高级中学
 高二化学苏教版选修4过关检测试题
高二化学苏教版选修4过关检测试题
时间:100分钟 分值:120分
第Ⅱ卷(共64分)
三、(本大题共2小题,共16分)
17.(10分)
(1)___________ (2)
(3) (4)_______ ________
(5)
18.(6分)
(1) 、 ; 、 ; 、 ;
(2)
四、(本大题共4小题,共26分)
19. (6分)
(1) (2)
(3)
(4)_______ ________
20. (5分)
(1) (2) (3)
21. (8分)
(1)
(2)① 、
② 、
22. (7分)
(1) (2)
(3)
五、(本大题共2题,共15)
23. (7分)
(1) (2)
(3) (4)
24. (8分)
(1) (2)
(3)① ②
(4)
六、(本大题共1题,共7分)
25.(写出详细的解题过程)