高二化学(X科)第一学期期末考试
试题
说明:1、本卷考查《化学反应原理》,共150分,考试时间:120分钟。
2、可能用到的相对原子质量:H - 1 C - 12 O - 16 N - 14 Na -23
Al - 27 S - 32 Ca - 40 Fe - 56 Cu - 64 Ag - 108
第一卷(70分)
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A、X的能量一定高于M
B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
2、在pH=1的无色溶液中,下列离子能大量共存的是 ( )
A.NH4+、Ba2+、NO3—、CO32— B.Fe2+、OH—、SO42—、MnO4—
C.K+、Mg2+、NO3-、SO42— D.Na+、Fe3+、Cl—、AlO2—
3、在密闭容器里,A与B反应生成C,其反应速率分别用![]() 、
、![]() 、
、![]() 表示,已知2
表示,已知2![]() =3
=3![]() 、3
、3![]() =2
=2![]() ,则此反应可表示为( )
,则此反应可表示为( )
A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
4、下列说法正确的是( )
A、可逆反应的特征是正反应速率和逆反应速率相等
B、在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C、在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D、在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
5、相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
6、下列说法正确的是( )
A、物质的溶解性为难溶,则该物质不溶于水
B、不溶于水的物质溶解度为0
C、绝对不溶解的物质是不存在的
D、某离子被沉淀完全是指该离子在溶液中的浓度为0
7、化学电池可以直接将化学能转化为电能,化学电池的本质是 ( )
A.化合价的升降 B. 电子的转移 C.氧化还原反应 D.电能的储存
8、随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是
A、利用电池外壳的金属材料
B、防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C、不使电池中渗泄的电解液腐蚀其他物品
D、回收其中石墨电极
9、在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
10、下列对化学平衡移动的分析中,不正确的是 ( )
![]() ①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量
时,平衡一定向正反应方向移动
![]() ②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正
反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向
移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11、反应4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) 在2 L的密闭容器中进行,1分钟后,NH3减少了0.12 mol,则平均每秒钟各物质浓度变化正确的是
A、 NO:0.001 mol·L-1 B、 H2O:0.002 mol·L-1
C、 NH3:0.002 mol·L-1 D、 O2:0.001 mol·L-1
12、常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
A.S2- B.CO32- C.NH4+ D.Br-
13、下列水解化学方程式或水解离子方程式正确的是:( )
A.CH3COO—
+ H2O![]() CH3COOH + OH— B.NH4+
+ H2O
CH3COOH + OH— B.NH4+
+ H2O![]() NH4OH + H+
NH4OH + H+
C.CH3COOH
+ NaOH![]() CH3COONa + H2O D.NaCl + H2O
CH3COONa + H2O D.NaCl + H2O![]() NaOH + HCl
NaOH + HCl
14、近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
|
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I – – 6e – + 3H2O = IO3 – + 6H+
C.溶液调节至强酸性,对生产有利
D.电解前后溶液的pH几乎不变
15、把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
A.c (CH3COO-)>c (Na+) B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-) D.c (CH3COOH)+c (CH3COO-)=0.01mol/L
16、把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:
Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是( )
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液pH值不变 D.溶液pH值增大
![]() 17、据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH— 2CO32— + 6H2O,则下列说法正确的是( )
17、据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH
+ 3O2 + 4OH— 2CO32— + 6H2O,则下列说法正确的是( )
A.构成该电池的正极和负极必须是两种活性不同的金属
B.充电时有CH3OH生成的电极为阳极
C.放电时电解质溶液的pH逐渐增大
D.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
18、一定条件下,向一带活塞的密闭容器中充入1 mol N2和3mol H2 ,发生下列反应:N2(g)+3H2(g)![]() 2NH3(g),反应达到平衡后,改变下述条件,NH3 气体平衡浓度不改变的是( )
2NH3(g),反应达到平衡后,改变下述条件,NH3 气体平衡浓度不改变的是( )
A.保持温度和容器压强不变,充入1 mol NH3(g)
B.保持温度和容器体积不变,充入1 mol NH3(g)
C.保持温度和容器压强不变,充入1 mol N2(g)
D.保持温度和容器体积不变,充入1 mol Ar(g)
19、今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH== ckJ·mol-1,
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a== b D.2b== c
20、草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-) B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4) D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
第二卷(80分)
三.实验题(本题包括2小题,共20分)
21.(8分)
Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.7g食盐
B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液
D.用200ml容量瓶配制500ml 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:

c (NaOH) = ________________________________。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏___________。
22、(12分)实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH,为准确滴定,终点宜选在pH:4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 色时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸VmL,则盐酸的物质的量的浓度为 mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为c2 mol/L。在下述情况下,c1与c2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则c1 c2。
②当Na2CO3中含有NaOH时,则c1 c2。
四、填空题(本题包括6小题,共42分)
23.(共5分)
(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
(2)已知CH4(g)+2O2(g)== CO2(g)+2H2O(l);ΔH=-Q1kJ·mol-1 ,
![]() =2H2O(g);△H2=-Q2 kJ·
=2H2O(g);△H2=-Q2 kJ·![]() ,
,
![]() =2H2O(l);△H2=-Q3 kJ·
=2H2O(l);△H2=-Q3 kJ·![]() 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为 。
24.(3分)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
25.(8分)在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
26.(6分)现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3 溶液的试管微热时,
观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是
。(结合反应方程式说明)
27.(8分)I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
 II.①某同学用碳棒、铜棒和稀硫酸为原材
II.①某同学用碳棒、铜棒和稀硫酸为原材
料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在右边画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
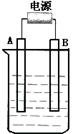 28.(12分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
28.(12分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
(1)A接的是电源的 极,B是该装置的 。
(2)写出电解时反应的总离子方程式
。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
五、(本题包括2小题,共18分)
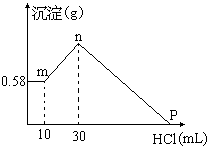 29.(8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物 溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
29.(8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物 溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
(1)混合物中NaOH的质量是__________________ (g);
AlCl3的质量是__________________ (g);
MgCl2的质量是 __________________(g)。
(2)P点所表示盐酸加入体积是____________(mL)。
30.(10分)已知可逆反应CO + H2O(g) ![]() CO2 + H2,达到平衡时,K =
CO2 + H2,达到平衡时,K =![]() ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度c (H2) = c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a = __________c。
 第一学期期末考试
第一学期期末考试
高二化学(X科)试题答题卷
| 题号 | 一 | 二 | 三 | 四 | 五 | 总分 |
| 得分 |
|
|
|
|
|
|
第一卷(70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第二卷(80分)
三.实验题(本题包括2小题,共20分)
21、(8分)
I.
II.(1)
(2)
(3)
22、(12分)
(1)
(2)
(3)① ②
四、填空题(本题包括6小题,共42分)
23、(5分)
(1) (3分)
(2) (2分)
24、(3分)
25、(8分)
(1) (2)
(3) (4)
26、(6分)
27、(8分)
I.(1)
(2)
II.①
②
28、(12分)
(1)
(2)
(3)
五、(本题包括2小题,共18分)
29、(8分)
(1)
(2)
30、(10分)
(1)
(2)
(3)
高二化学(X科)参考答案
第一卷(70分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | A | B | C | C | C | B | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | A | C | A | BD | AD | C | D | AD | D | D |
第二卷(80分)
21、(8分) Ⅰ.__A C_________ (填序号)
Ⅱ.(1)用已知物质的量浓度的标准盐酸润洗2到3次
(2)c (NaOH) = ![]() 。
。
(3)高
22、(10分)
(1)甲基橙。黄、橙。
(2)1000W/53·V
(3)提示:据Na2CO3——2HCl
106g 2mol
NaHCO3——HCl NaOH——HCl
84g 1mol 40g 1mol
所以等质量时,NaHCO3消耗HCl的体积最少。NaOH消耗HCl的体积最多。
再据c(HCl)![]() ,可知:V(HCl )消耗越多,c(HCl)越小。
,可知:V(HCl )消耗越多,c(HCl)越小。
故①c1 < c2 ②c1 > c2
23、(共5分)(1)C(S)+H2O(g) == CO(g) +H2(g) ΔH= +131.28 kJ·![]() (3分)
(3分)
(2)0.4Q1+0.05Q2 (2分)
24.(3分) HA、HC、 HB、HD(或HA>HC> HB>HD)
25.(8分)
(1)m+n>p (2)固 (3)逆反应方向 (4)吸热
26.(6分)因NaHCO3 溶液中存在HCO3-
+H2O ![]() H2CO3+OH- 的水解平衡,(1分)水解反应为吸热反应,(1分)加热使水解平衡向右移动,(1分)c(OH-)增大,溶液的浅红色加深;(1分)降温时,平衡向左移动,(1分)c(OH-)减小,溶液颜色变浅。(1分)
H2CO3+OH- 的水解平衡,(1分)水解反应为吸热反应,(1分)加热使水解平衡向右移动,(1分)c(OH-)增大,溶液的浅红色加深;(1分)降温时,平衡向左移动,(1分)c(OH-)减小,溶液颜色变浅。(1分)
27.(8分)I. (1)吸氧
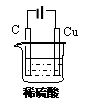 (2)2H2O+O2+4e-=4OH-.
(2)2H2O+O2+4e-=4OH-.
II.①
②两极与电源的正负极接反了,或铜棒接电源的负极了等。
28、(10分)
(1) 负, 阳极 (2)2Cu2++2H2O
2Cu+O2↑+4H+ (3)1;CuO,2g
29、(8分)⑴2.6g;1.335g;0.95g; ⑵130。
30、(10分)
(1) CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) 2 3 0 0
转化浓度 1.2 1.2 1.2 1.2
平衡浓度 0.8 1.8 1.2 1.2
K=![]()
![]()
(2)设CO的转化浓度为x CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为 mol/L) 2 6 0 0
转化浓度 x x x x
平衡浓度 2 – x 6 – x x x
K =![]() ,x = 1.5 mol/L
,x = 1.5 mol/L ![]()
(3) CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) a b 0 0
转化浓度 c c c c
平衡浓度 a – c b – c c c
①![]() ,②a = b,则a =
2c
,②a = b,则a =
2c