高二学业水平测试模拟试卷二
化 学 试 题
| 注 意 事 项 本试卷分为第I卷和第II卷两部分。试卷1至8页。共100分。考试时间75分钟。 1. 答卷前,考生务必将本人的学校、班级、姓名、学号、考试号填在第II卷的密封线外和机读卡上。 2. 将第I卷答案用2B铅笔填涂在机读卡上,在试卷上答题无效。第II卷直接在试卷上作答。 3. 考试结束,请将机读卡和第II卷交给监考人员。 |
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56
第I卷(选择题,共69分)
一、本大题共17题,每题3分,共51分。在每题四个选项中,只有一个选项是符合要求。
1. “善待地球——科学发展。”下列行为中不符合这一主题的是
A.发展循环经济,构建资源节约型社会
B.加高工厂的烟囱,使烟尘和废气远离地表,减少污染
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
 D.采用“绿色化学”工艺,建立环境友好型化工体系
D.采用“绿色化学”工艺,建立环境友好型化工体系
2.2008年北京奥运会火炬以中国传统祥云符号和纸卷轴为创意,由铝合金制成,使用的燃料为丙烷。下列说法不正确的是
A.丙烷充分燃烧的产物是水和二氧化碳 B.丙烷燃烧是吸热反应
 C.铝柄有一层致密的氧化膜可防止其腐蚀
C.铝柄有一层致密的氧化膜可防止其腐蚀
D.火炬燃料用丙烷比用煤油更环保
3.右图是 10ml 量筒的一部分,数字XY之间相差 1ml
若 X=5,则量筒所盛液体的体积是
A. 5.7 ml B. 4.4 ml C. 4.3 ml D. 6.3 ml
4. 某课外活动小组使用下列用品设计原电池。下列说法正确的是
用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL、烧杯。
A.该装置能将电能转化为化学能
B.实验过程中铜片逐渐溶解
C.铁片上会析出红色的铜
D.电子由铁片通过导线流向铜片
5.下列各组中,两者既不是同位素,也不是同素异形体,还不是同分异构体的是
A.D和T B.乙酸和甲酸甲酯 C. K和Ca D.金刚石和石墨
![]() 6.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为
6.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为
2KNO3+S+3C K2S+N2↑+3CO2↑。该反应中被还原的元素是
A.N B.C C.N和S D.N和C
7. 下列离子方程式的书写正确的是
A.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO![]() =BaSO4↓
=BaSO4↓
B.钠与水的反应Na + 2H2O === Na+ + 2OH -+ H2↑
C.氯气通入氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
8.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,48gO3和48gO2含有的氧原子数均为3NA
B.1.8g的NH4+离子中含有的电子数为0.1NA
C.11.2L氧气中所含有的原子数为NA
D.标准状况下,1 L水所含分子数为![]() NA
NA
9.下列关于物质分类的正确组合是
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯 碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | 烧 碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
| C | 苛性钾 | 醋酸 | 食盐 | 氧化铝 | 二氧化硫 |
| D | 苛性钠 | 硫酸 | 纯碱 | 氧化钠 | 三氧化硫 |
10.下列有关物质用途的说法中,正确的是
A.二氧化硅可用来制造半导体材料 B.明矾净水利用了胶体的吸附性
C.碳酸钠可用于治疗胃酸过多 D.硅可用于制造光导纤维
11.下列化学用语的书写,正确的是
A.氮气的电子式:![]() B.硫原子的结构示意图:
B.硫原子的结构示意图:![]()
 C.溴化钠的电子式:
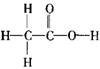
C.溴化钠的电子式: ![]() D.乙酸的结构式:
D.乙酸的结构式:
12.下列说法错误的是
A.催化剂可以改变化学反应速率 B.食物放在冰箱中会减慢食物变质的速率
C.2mol SO2与 1mol O2混合一定能生成2mol SO3
D.锌与稀硫酸反应时,加入少量铜粉能加快产生氢气的速率
13.下列叙述不正确的是
A.原子半径:H<Al<Mg<Na B.热稳定性:HCl>H2S>PH3>AsH3
C.P、S、Cl元素最高价氧化物对应的水化物酸性依次增强
D.N、O、F元素非金属性依次减弱
14.无论在化学实验室还是在家中进行实验或探究活动,都必须注意安全。下列实验操作正确的是
A.配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓H2SO4
B.不慎将酒精洒到桌面上引起着火,应立即用较多的水浇灭
C.从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
D.为防止试管破裂,加热固体时试管口一般要略低于试管底
15.下列各组离子中,能在溶液中大量共存的是
A.Ba2+、Cl-、Na+、SO42- B.Na+、OH-、K+、NO3-
C.H+、NO3-、K+、Fe2+ D.H+、Cl-、K+、ClO--
16.取等物质的量的镁粉和铝粉混合,再将混合物平均分为四份,分别加入足量的下列溶液中,充分反应后放出氢气最多的是
A.3mol/L的HCl B.4mol/L的HNO3
C.8mol/L的NaOH D.18mol/L的H2SO4
17.下列有机物发生的反应属于加成反应的是
A.乙烯使KMnO4溶液褪色 B.乙烯使溴的四氯化碳溶液褪色
C.甲烷和氯气混合,见光 D.用乙醇、乙酸与浓H2SO4混合加热
二、本大题包括“(一)化学与生活”和“(二)有机化学基础”两个模块各6题,每题3分,每个模块18分。每位考生只需选择其中一个模块作答,若两个模块均作答,则以第一个模块计算成绩。在每题的四个选项中,只有一个选项是符合要求的。
(一)化学与生活
18.下列有关物质用途的说法中,正确的是
① 乙烯可用作催熟果实;② 纤维素可以用于造纸;③ 福尔马林用于浸泡生物标本;
④ CCl4可以用作高效灭火剂
A.只有①② B.只有③④ C.只有②③④ D.①②③④都正确
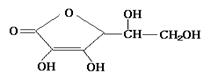
19.维生素C是一种水溶性维生素(其水溶液呈酸性)化学式为C6H8O6,结构如下图所示。人体缺乏这种维生素C易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500mg/L左右。下列关于维生素C的叙述错误的是
 A.维生素C能使溴水褪色
A.维生素C能使溴水褪色
B.维生素C可作食品添加剂
C.维生素C可发生酯化反应
D.维生素C在碱性条件下能稳定存在
20.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以KIO3形式存在。已知在溶液中IO3—与I—反应:IO3—+5I—+6H+===3I2+3H2O。根据此反应,可用试纸和一些生活中常用物质进行检验,证明在实验中存在IO3—。进行上述实验时必须使用的物质为(从以下物质中选)①自来水②蓝色石蕊试纸③碘化钾淀粉试纸④淀粉⑤食糖⑥食醋⑦白酒
A、①③ B、③⑥ C、②④⑥ D、①②④⑤⑦
21.生活中处处有化学。请根据你所学过的化学知识,判断下列说法中不正确的是
A.当有人出现水杨酸反应,医生可采取静脉注射0.9%NaHCO3溶液
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.食品中的微量元素含量偏高会造成中毒反应,必须严格控制。如:As、Cd、Hg
D.用油料作物生产的生物柴油成分与从石油中提取的柴油成分相同
22.目前,已发现的居室空气污染物达300多种。其中有一种来自人造地板、家具以及装修粘合剂,长期接触低剂量的该物质,可引起过敏性皮炎、免疫功能异常。该污染物是
A.甲醛 B.一氧化碳 C.氡 D.丁烷
23.对于药品的使用和作用下列说法不正确的是
A.青霉素等抗生素对病原体有抑制和杀灭作用,但在使用之前要进行过敏性实验
B.吗啡、海洛因等虽然有麻醉、止痛、镇静作用,但易上瘾且有害,这类物质属于毒品
C.麻黄碱是国际奥委会严格禁止使用的兴奋剂
D.R表示非处方药,OTC表示处方药
(二)有机化学基础
18.下列说法中,错误的是
A.石油液化气的主要成分是碳氢化合物
B.甲醇有剧毒,误饮很少就能使眼睛失明甚至致人死亡
C.煤是由有机物和无机物组成的复杂的混合物
D.石油的分馏产品如汽油、煤油、柴油等都是纯净物
19.在核磁共振氢谱图(1H核磁共振谱图)中,只有一个吸收峰的物质是
A.CH3CH2OH B.CH3CH2CH3 C.CH2=CH-CH3 D.CH3CH3
20、 下列反应中, 属于取代反应的是
A. C2H5OH C2H4↑+ H2O
![]()
![]() B. +Br2 + HBr
B. +Br2 + HBr
C. CH2=CH2 + Br2 ─→ CH2Br-CH2Br
D. 2CH3CH2OH + O2 2CH3CHO + 2H2O
21、咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为: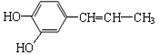
下列关于咖啡酸的说法中,正确的是
A.属于芳香烃 B.分子式为C9H7O2
C.不能使酸性KMnO4溶液褪色 D.与过量的浓溴水发生反应生成白色沉淀
22.下列有关高分子材料的表述不正确的是
A.合成高分子材料都很难降解
B.塑料、合成纤维、黏合剂、涂料等是合成高分子材料
C.棉花、羊毛、天然橡胶等属于天然高分子材料
D.线型和体型高分子材料在溶解性、热塑性和热固性等方面有较大的区别
23、下列说法中,正确的是
A.可以用浓NaOH溶液除去乙酸乙酯中的乙酸
B.往蛋白质溶液里加入饱和(NH4)2SO4溶液会产生沉淀,再加水稀释,沉淀不溶解
C.可以用酒精萃取碘水中的碘
D.甘氨酸( ![]() )既能与盐酸又能与氢氧化钠反应
)既能与盐酸又能与氢氧化钠反应

化学试题
| 卷别 | 第I卷 | 第Ⅱ卷 | 总分 | 积分人 | 核分人 | |||
| 题号 | 一、二(1-23) | 三(24-25) | 四 | |||||
| 26 | 27 | 28 | ||||||
| 得分 | ||||||||
注意事项:
1、 请用蓝黑水笔或钢笔直接答在试卷上。
2、 答卷前将密封线内项目填写清楚。
第I卷选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | —— |
| 答案 |
第Ⅱ卷(非选择题,共31分)
三、本大题包括“(一)化学与生活”和“(二)有机化学基础”两个模块各2题,每个模块12分。每位考生只需选择其中一个模块作答,若两个模块均作答,则以第一个模块计算成绩。
(一)化学与生活
24.(6分)为分析某县城的空气质量情况,某校化学研究性学习小组的同学拟测定该县城空气中SO2的含量。
⑴ 检验SO2可选用 试液。
⑵ SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。该反应的现象是 ,SO2在该反应中显 (填“氧化”或“还原”)性。
⑶ 该小组的同学拟用下列装置运用“⑵”中的反应原理定量分析空气中SO2的含量:

① 装置中棉花的作用是 ,通入空气前应进行的实验操作是 ;
② 该实验中需要知道的数据除气体流速、酸性KMnO4溶液的体积外还有 。
25.(6分)蛋白质是生命的基础,没有蛋白质就没有生命。请回答下列问题:
⑴ 人体摄入的蛋白质在胃蛋白酶和胰蛋白酶的作用下,水解成 ,被人体吸收后,重新结合成人体所需的蛋白质。人体内蛋白质也在不断分解,最后生成尿素排出体外。
⑵ 蛋白质在一定条件下能发生变性,从而失去生理活性。万一误服硫酸铜溶液,此时应立即作怎样的处? 。
⑶青霉素是医学上一种常用的抗生素,在体内经酸性水解后得到青霉氨基酸其结构简式为:
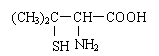
,请写出青霉氨基酸可能具有的一种化学性质
。
(二)有机化学基础
24.(7分)下图各有机物相互转化关系中,无色气体A为石油裂解的产品之一,A的产量可以用来衡量一个国家石油化工水平。B、D均为日常生活中的常见的有机物。
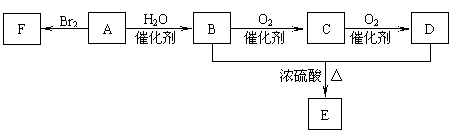
回答下列问题:
⑴ F的结构简式为 ,C的名称为 。
⑵ A生成B的反应方程式为 ,反应类型为 ;B和D反应生成E的反应方程式为 ,反应类型为 。
⑶ 将加热到红热的铜丝擦入B中,反复几次,观察到的现象为 。
25.(5分)聚苯乙烯是一种发泡塑料,可用于包装材料等。聚苯乙烯的结构简式为:
-[-CH2—CH(C6H5)-]n-。试回答下列问题:
(1)聚苯乙烯的单体是(写结构简式): 。
(2)实验测得某聚苯乙烯的相对分子质量为52000,则该高聚物的聚合度n的值为: 。
(3)试推测聚苯乙烯是 型分子(添线型或体型),它能否溶解于CHCl3,
(填“能”或“否”),它具有 性(填“热塑”或“热固”)。
四、本大题共3题,共19分。
26.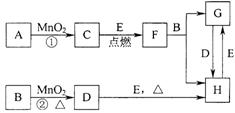 (8分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(8分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:B ,G 。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(4)写出B与MnO2共热获得D的化学方程式 。
27.(7分)江苏省有较长的海岸线,海洋资源十分丰富。
⑴从海水中提取镁的主要步骤如下:
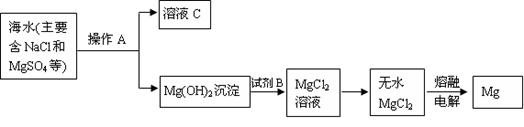
①上述从海水中提取镁的步骤中,试剂A可以选用 ,试
剂B选用 。
②分离出Mg(OH)2后的溶液C中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸。实验中加入过量BaCl2溶液是为了除去 离子;加入过量Na2CO3溶液发生反应的离子方程式是 、 。
⑵写出实验室蒸馏海水装置中两种玻璃仪器的名称 。
28.(4分) 50mL Na2CO3和Na2SO4混合溶液中加入足量的氯化钡溶液,得到14.51克白色沉淀,用过量的稀盐酸处理沉淀,剩余固体质量为4.66克。(相关物质的式量为:BaSO4-233;BaCO3-197;BaCl2-208;Na2CO3-106;Na2SO4-142)
(1)写出有关反应的化学方程式。
(2)原溶液中碳酸钠的物质的量浓度。
化学试题参考答案及评分标准
第一卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | B | C | D | C | C | D | A | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | B | D | C | D | D | B | A | B |
《化学与生活》
| 题号 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | D | D | B | D | A | D |
《有机化学基础》
| 题号 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | D | D | B | D | A | D |
第二卷
《化学与生活》
24.(6分,每空1分)⑴ 品红 ⑵ 紫色溶液褪色 还原
⑶ ① 防止固体颗粒进入KMnO4溶液 检查装置的气密性 ② 酸性KMnO4溶液的浓度
25.(6分,每空2分) ⑴ 氨基酸 ⑵ 喝大量的牛奶(或豆浆或鸡蛋清)或灌肥皂水(任写出一种即可) ⑶ 四肽 酸性、碱性、与金属钠反应、能发生酯化反应等(任写出一种即可)
《有机化学基础》
![]() 24.(7分,每空1分)
24.(7分,每空1分)
⑴ Br-CH2CH2-Br 乙醛 ⑵ CH2=CH2+H2O CH3CH2OH 加成
![]()
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 酯化(取代)
⑶ 铜丝表面由黑变红,有刺激性气味产生
25.(5分,每空1分)(1)CH2=CH-C6H5 (2)650 (3)线型 能 热塑
26.(8分,最后一空2分其余各一分)
(1)B 盐酸,G FeCl2。(2)催化剂, 氧化。(3)KClO3; H2O2。
(4)MnO2 + 4HCl(浓)== MnCl2 + 2H2O + Cl2↑
27.(7分,每空1分)
(1)①Ca(OH)2 稀盐酸
②SO42— Ca2+ +CO32—=CaCO3↓,Ba2+ +CO32—=BaCO3↓
(2)蒸馏烧瓶、冷凝管、锥形瓶等
28.(4分)(1)方程式2分,
(2)1mol/l 2分。