高二年级化学上学期必选模块水平测试
(试卷满分:100分;考试时间:90分钟)
第I卷(选择题,共44分)
温馨提示:
1、第Ⅰ卷共4页。答第Ⅰ卷前,考生务必将自己的姓名、准考证号填写在第5页密封线内的相应空格中。
2、选择题选出答案后,把答案的序号填写在第5页的选择题答题表中。
相对原子质量:H:1 C:12 O:16 Na:23 Mg:24
Al:27 S:32
一、选择题(本题共有22小题,每小题2分,共44分,每小题只有一个选项符合题意)
1.下列叙述正确的是
A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
2.下列物质,属于强电解质的是
A.NH3.H2O B.H2O
C.CH3COONH4 D.CH3COOH
3.下列说法正确的是
A.放热反应一定都是自发的
B.电解池的反应属于自发过程
C.反应能否自发进行与温度有关
D.能自发进行的化学反应,一定是△H>0、△S>0
4.下列说法正确的是
A.KW随浓度的改变而改变
B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变
D.一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱
5.在化学反应A(g)+3B(g) ![]() 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
A.vA=vB
B.vA=2vC
C.3vB=vC
D.vB=3vD
6.已知:在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气,放出484kJ热量。下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
7.下列说法正确的是
A.含有H+离子的溶液一定呈酸性
B.0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等
C.pH为1的盐酸的c(H+)是pH为3的盐酸的100倍
D.Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍
8.下列各组热化学方程式程中,△H的绝对值前者大于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5
2H2(g)+O2(g)=2H2O(l);△H6
A.①
B.② C.② ③
D.①②③
9.下列反应的离子方程式正确的是
A.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
B.用小苏打治疗胃酸(含盐酸)过多:HCO3-+H+=CO2↑+H2O
C.盐酸滴入氨水中:H++OH-=H2O
D.碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O
10.用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
A.NaCl溶液
B.HCl溶液
C.稀NaOH溶液
D.AgNO3溶液
11.用锌和1mol/L稀硫酸溶液制取氢气,欲提高制取氢气的速率,下列措施不可行的是
A.改用98%的浓硫酸 B.使用更小颗粒的锌粒
C.滴入少量CuSO4溶液 D.加热
12.在一定条件下,对于在密闭容器中进行的反应:P(g)+Q(g) ![]() R(g)+S(g),下列情况已经达到化学平衡状态的是
R(g)+S(g),下列情况已经达到化学平衡状态的是
A.P、Q、R、S的浓度相等
B.P、Q、R、S在密闭容器中共存
C.P、Q、R、S的浓度不再变化
D.容器内的压强不再变化
13.0.10 mol/L盐酸和0.12 mol/L NaOH溶液等体积混合后,溶液的pH等于
A. 2.0 B.
12.3
C.
1.7 D.
12.0
14.化学反应C(s)+H2O(g)![]() CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
A.减小压强,平衡向正反应方向移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡向逆反应方向不移动
D.加入固体碳,平衡向正反应方向移动
15.氯化银在水中存在溶解平衡:AgCl ![]() Ag++Cl—。在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是
Ag++Cl—。在相同温度下,将足量氯化银分别放入相同体积的下列溶液中,Ag+的浓度最小的是
A. 0.1mol/L HCl B.蒸馏水 C.0.1mol/LAlCl3 D.0.1mol/LMgCl2
16.合成氨的反应是:N2(g)+3H2(g)![]() 2NH3(g);△H<0。能使合成氨反应进行程度增大的方法是
2NH3(g);△H<0。能使合成氨反应进行程度增大的方法是
A.升高温度 B.降低压强 C.使用催化剂 D.及时分离出NH3
17.已知0.1mol/L的醋酸溶液中存在电离平衡: CH3COOH![]() CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
A.加少量CH3COONH4固体 B.降低温度 C.加少量NaCl固体 D.升高温度
18.常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得溶液的pH
A.等于7
B.大于7 C.小于7 D.无法确定
19.下列说法不正确的是
A.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4 OH-
B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀
C.铸铁输油管道应埋在干燥致密不透气的土壤中
D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
20.常温下,纯水中存在电离平衡:H2O![]() H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
A.H2SO4 B.AlCl3 C.NaHCO3 D.NaOH
21.氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的的是
A. NaOH
B. CuO
C.Cu(OH)2 D.Cu(OH)2CO3
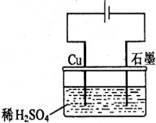 22.某同学按右图所示的装置进行电解实验。下列说法正确的是
22.某同学按右图所示的装置进行电解实验。下列说法正确的是
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
泉州市2007—2008学年度高二年上学期普通高中新课程模块水平测试
2008.1
化 学(化学反应原理)
(试卷满分:100分;考试时间:90分钟)
登分表:
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 得分 |
|
|
|
|
|
选择题答题表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 |
第Ⅱ卷(非选择题,共56分)
 二、填空题(本题有4小题,共36分)
二、填空题(本题有4小题,共36分)
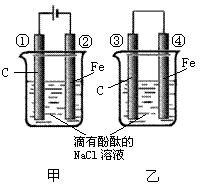
23.(10分)化学能和电能的相互转化,是能量转化的重要方式之一,右图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为
检验该电极反应产物的方法是
(4)甲、乙两装置电极附近的溶液首先变红的电极分别是 、 (填序号)
(5)写出装置甲的反应总方程式
24.(10分)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
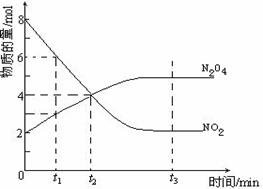 25.(8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)
25.(8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)![]() N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)
26.(8分)把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) === CO2(g)
途径II:先制水煤气: C(s) + H2O(g) === CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) === 2CO2(g);
2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ ![]() O2 (g)
=CO2(g);△H3=-283.0kJ·mol-1
O2 (g)
=CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C的标准燃烧热是 kJ·mol-1
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
三、实验题(本题有2小题,共20分)
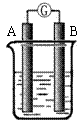
27.(8分)某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
| 实验 序号 | A | B | 烧杯中的液体 |
针是否偏转 |
| 1 | Zn | Zn | 乙醇 | 无 |
| 2 | Zn | Cu | 稀硫酸 | 有 |
| 3 | Zn | Zn | 稀硫酸 | 无 |
| 4 | Zn | Cu | 苯 | 无 |
| 5 | Cu | C | 氯化钠溶液 | 有 |
| 6 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验2中电流由 极流向 极(填“A”或“B”)
(2)实验6中电子由B极 流向A极 ,表明负极是 电极(填“镁”或“铝”)
(3)实验5 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种非金属)
28.(12分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上褪色变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
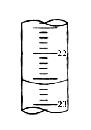 (1)锥形瓶中的溶液从 色变为
色时,停止滴定。
(1)锥形瓶中的溶液从 色变为
色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是
由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)右图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
请计算待测烧碱溶液的浓度: mol/L
化学反应原理参考答案
一、选择题(每小题各2分,共44分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | A | C | C | B | D | A | C | A | B | A | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | D | A | B | D | D | B | D | B | A | B |
二、填空题(本题有4小题,共36分)
23.(10分)
(1)乙 (1分) (2) Fe -2e-=Fe2+ (2分)
(3) 2Cl- +2e-= Cl2 ↑ (2分)
把生成的气体通入淀粉KI溶液中,若有蓝色出现,则说有Cl2生成 (1分)
(4)②、③ (各1分,共2分)
(5)2NaCl + 2H2O ![]() 2NaOH
+ Cl2 ↑+ H2 ↑
(2分)
2NaOH
+ Cl2 ↑+ H2 ↑
(2分)
24.(10分)
(1)酸 (1分)
NH4+ + H2O
![]() NH3·H2O + H+
(2分)
NH3·H2O + H+
(2分)
(2)③;⑤ (各1分,共2分)
(3)< (1分)
(4)Cl- ;NH4+ (各1分,共2分)
(5) = ; = (各1分,共2分)
25.(8分)
(1)![]() (2分)
(2分)
(2)0.1 (1分)
(3)t3 (2分)
(4) > (1分)
(5)正反应应方向 (1分)
(6)变深 (1分)
26.(8分)
(1)393.5 (2分)
(2)C(s)+H2O(g)===CO(g) + H2(g);△H =+131.3 kJ·mol-1 (2分)
(3)< (2分)
(4)A (2分)
三、实验题(本题有2小题,共20分)
27.(8分)
(1)B;A (各1分,共2分)
(2)铝 (2分)
(3)B (2分)
(4)A (2分)
28.(12分)
(1)红 无 (各1分,共2分)
(2)B (2分)
(3)用待测液润洗锥形瓶 偏高 (各1分,共2分)
(4)用标准液润洗滴定管 (2分)
(5) 22.60(22.59也给分) (2分)
(6) 0.08 (2分)
 灵敏电流计指
灵敏电流计指