高二年级化学上学期期末考试试题
化 学 试 题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间为90分钟。
第Ⅰ卷(选择题 共50分)
注意事项:
1.答第Ⅰ卷前,考生必将自己的姓名、考号、考试科目、试卷类型(A或B)涂写在答
题卡上。考试结束时,将试题答题纸和答题卡一并交回。
2.每小题选出答案后,用铅笔把答题卡上以应题目的答案标号涂黑,如需改动,用橡
皮擦干净后,再选涂其它答案。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27
一、选择题(本题包括 25 小题,每小题 2 分,共50分。每小题只有一个选项符合题意)
1.下列说法一定正确的是
A.强电解质溶液的导电性比弱电解质溶液的导电性强
B.![]() 投入水中,导电性较弱,故它是弱电解质
投入水中,导电性较弱,故它是弱电解质
C.弱电解质溶液中至少存在两种共价化合物分子
D.氯水能导电,所以![]() 也是电解质
也是电解质
2、将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大、pH变小、呈酸性
B. 水的离子积不变、pH不变、呈中性
C. 水的离子积变大、pH变小、呈中性
D. 水的离子积变小、pH变大、呈碱性
3.在一定条件下,可逆反应 A(g)+ B(g) ![]() 2C(g)达到平衡的标志是
( )
2C(g)达到平衡的标志是
( )
①A、B、C的分子数比为1∶1∶2 ②A、B、C的浓度不再产生变化
③ 单位时间生成n摩尔 A,同时增加2n摩尔 C
④平衡体系中的压强不再发生变化
A.①② B.①④ C.②③ D.②④
4.现有100毫升3mol/L的NaOH溶液和100毫升1mol/L的氯化铝溶液:⑴将NaOH溶液分多次加到氯化铝溶液中;⑵将氯化铝溶液分多次加到NaOH溶液中。比较两种操作的结果是
A.现象相同,沉淀量不等 B.现象相同,沉淀量也相等
C.现象不同,沉淀量相等 D.现象不同,沉淀量不等
5、下列事实能说明亚硝酸是弱电解质的是:
①亚硝酸钠溶液的PH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L—1HNO2溶液的PH=2.1
A、①②③ B、②③④
C、①④ D、①②④
6.25℃时,某NH4Cl溶液的pH=4,下列说法正确的是
①溶液中c(![]() )>c(
)>c(![]() ),且c(
),且c(![]() )·c(
)·c(![]() )=1×
)=1×![]()
②由水电离出的c(![]() )为1×
)为1×![]()
![]()
③溶液中c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )
)
A.①②③ B.①② C.①③ D.②③
7.对于反应:2SO2+O2
![]() 2SO3
(正反应为放热反应)下列判断正确的是
2SO3
(正反应为放热反应)下列判断正确的是
A.2体积SO2和过量的O2反应,必定生成2体积SO3。
B.其他条件不变,升高温度,平衡必定向右移动。
C.平衡时,SO2的消耗速率必定等于O2生成速率的两倍。
D.平衡时,SO2浓度必定等于O2浓度的两倍。
8.若溶液中由水电离产生的c(H+)=1×10 -13mol·L -1,满足此条件的溶液中一定可以大量共存的离子组是( )
A、Al3+、Na+、NO3-、Cl— B、K+、Na+、Cl -、SO42-
C、K+、Na+、Cl-、CO32- D、K+、I -、NO3-、Cl -
9.下列离子方程式正确的是
A.C12通入FeCl2溶液中:2Fe2++Cl2=2Fe3++2C1-
B.金属铝溶于盐酸中:2Al + 2OH- =2AlO2-+H2↑
C.A1(NO3)3溶液中加入过量氨水:A13++4NH3·H2O=A1O2-+4NH4++2H2O
![]() A.碳酸钠溶液显碱性:CO32-+2H2O H2CO3+2OH-
A.碳酸钠溶液显碱性:CO32-+2H2O H2CO3+2OH-
10.两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法正确的是( )
A. 混和气体中不一定有CH4 B. 混和气体中一定有甲烷和乙烯
C. 混和气体中一定没有乙烷 D. 混和气体中一定有乙炔
11、将Ba(OH)2 溶液滴入NH4Al(SO4)2溶液中,当SO42- 全部转化为BaSO4 沉淀时,铝元素的存在形式是
A、Al3+ 和Al (OH)3 B、Al (OH)3 C、AlO2- D、Al(OH)3和AlO2-
12.向一定量的 FeO、Fe、Fe3O4 Fe2O3的混合物中加入200ml1mol·L-1的盐酸,恰好使混合物完全溶解,放出224ml(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现.若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量是
A、11.2g B、5.6g C、2.8g D、无法计算
13.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
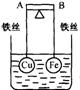 A.杠杆为导体和绝缘体时,均为A端高B端低
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
14. 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)=c(H+)+(NH4+)
![]() 15、某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g), 5分钟后达到平衡,各物质的平衡浓度的关系为:[c(A)]a·c(B)=c(C) ·c(D)。此时若在温度不变的情况下将容器扩大为原来的10倍,A的转化率不发生变化,则B的转化率为:
15、某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g), 5分钟后达到平衡,各物质的平衡浓度的关系为:[c(A)]a·c(B)=c(C) ·c(D)。此时若在温度不变的情况下将容器扩大为原来的10倍,A的转化率不发生变化,则B的转化率为:
A.60% B. 40% C. 24% D. 42%
16、相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是
A、电离程度:HCN>HClO
B、溶液的pH:HCN<HClO
C、与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HCN<HClO
D、酸根离子浓度: C(CN-)<C(ClO-)
17、将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
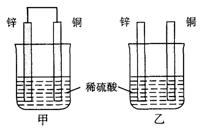 A.两烧杯中铜片表面均无气泡产生
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
18.常温时,以下4种溶液pH最小的是
A.0.01mol ·L-1醋酸溶液
B.0.02mol ·L-1醋酸与0.02mol ·L-1NaOH溶液等体积混合液
C.0.03mol ·L-1醋酸与0.01mol ·L-1NaOH溶液等体积混合液
D.pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液
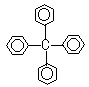 19.某有机物(如图)是甲烷被苯基取代的产物,下列说法不正确的是
19.某有机物(如图)是甲烷被苯基取代的产物,下列说法不正确的是
① 分子式为C25H20 ②此物质的属于苯的同系物
③ 此物质的一氯代物只有一种。
④所有碳原子不在一个平面上⑤此物质属于芳香烃
A.①⑤ B.①④ C.②③ D.④⑤
20.下列操作最终没有沉淀的是:( )
A. NaAlO2溶液中通入过量CO2 B. 饱和Na2SiO3溶液中通入过量CO2
C. MgCl2溶液中加入过量NaOH D. 明矾溶液中加入过量NaOH
21、某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液pH大于7,下表中判断合理的是 ( )
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
A.①③ B.②③ C.①④ D.②④
22、下列关于电解质溶液的叙述正确的是 ( )
A 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
23、我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4A1+3O2+6H2O=4A1(OH)3,下列说法不正确的是
A 正极反应式为:O2+2H2O+4e-=4OH-
B 电池工作时,电流由铝电极沿导线流向铂电极
C 以网状的铂为正极,可增大与氧气的接触面积
D 该电池通常只需更换铝板就可继续使用
24.右图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析
不能得出的结论是
A.A是反应物
B.前2 min A的分解速率为0.1 mol/(L•min)
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
25.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A. 9.0 B. 9.5 C. 10.5 D. 11.5
第Ⅱ卷(非选择题,共50分)
二、(本题包括4小题,共23分)
26.(8分)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” 下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
27.(8分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链链烃的结构简式 ____________ 。
(2)已知分子式为 C6H6 的结构有多种,其中的两种为

① 这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能_______(选填a、b、c、d,倒扣分)而Ⅰ不能
 a 被酸性高锰酸钾溶液氧化 b 与溴水发生加成反应,
a 被酸性高锰酸钾溶液氧化 b 与溴水发生加成反应,
c 与溴发生取代反应 d 与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:
Ⅰ需______mol,而Ⅱ需_______mol。
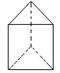
② 今发现 C6H6 还可能有另一种如右图立体结构:该结构的二氯代物有_______种。
(3)烷烃中脱水2 mol氢原子形成1 mol双键要吸热,但1,3—环己二烯(![]() )脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
(填稳定或不稳定)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3—环己二烯
(填稳定或不稳定)。
 (4)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列
事实(填入编号)
(4)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列
事实(填入编号)
a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
(5)现代化学认为苯分子碳碳之间的键是 。
28.(4分)
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:。
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
A、(CH3)2C=C(CH3) 2 B、CH3CH=CH CH3
C、CH2=CH2 D、CH2=CHCl
29、(3分)联苯![]() 的二溴代物有多种,其中两个溴原子位置对称的有五种, 并且碳碳单键能够旋转,如
的二溴代物有多种,其中两个溴原子位置对称的有五种, 并且碳碳单键能够旋转,如
![]()
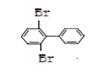
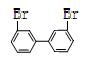
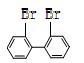
(1)请写出另外两种二溴代物的结构简式: 、 。
(2) 与
与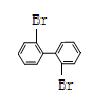 的相互关系是
的相互关系是
A.同分异构体 B.同系物 C.同一物质
三、推断题(本题共8分)
30、(8分)如图所示
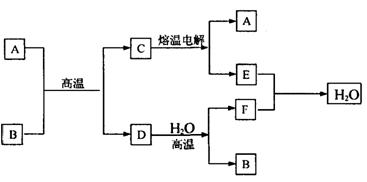
已知A、D、E、F是中学化学中的常见单质,B、C是氧化物,且B的式量是232。请填空:
(1)A是 ,E是 。(填化学式)
(2)D跟水反应的化学方程式是 。
 (3)C电解时,每生成1molA同时生成
molE。
(3)C电解时,每生成1molA同时生成
molE。
(4)先将B溶于足量盐酸,再在用盐酸溶解后的溶液中通人足量Cl2,请写出全过程中有关反应的离子方程式: 。
四、试验题(本题包括2小题,共15分)
31.(10分)
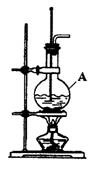
(1)在实验室制取乙烯的装置图(如下图)中,仪器A的名称是________.A中加入的两种试剂是____________________________.反应方程式为_____________________________.
乙烯的收集方法为________________________;
(2)将反应产生的乙烯通入酸性高锰酸钾溶液中,观察到的现象是
____________________________________;将反应产生的乙烯通入溴的四氯化碳溶液中,观察到的现象是____________________________________,反应的化学方程式为__________________________________________________________.
(3)反应进行一段时间后,A中混合液常变黑,并有刺激性气味的气体生成,该气体是________,若要验证有该气体生成,应将生成的气体通过________溶液;若要除去该气体应将生成的气体通过________溶液.
32. (5分)为探究CO2和NaOH确实发生了化学反应,某实验小组的同学设计了下列4种实验装置,请回答下列问题:
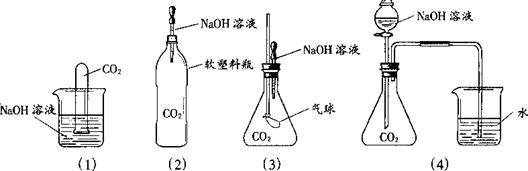
(1)选择实验装置(3),简述出现的实验现象以及产生该实验现象的原因:_________________ _______________________________________________________ 。
⑵某同学质疑上述所有实验设计,该同学质疑的依据是_______________________________
__________________________________________________________________________________
⑶在原实验的基础(4)上,请你设计实验证明CO2和NaOH肯定发生了化学反应的方法 。
五、(本题4分)
33、(4分) 标准状况下1.68L烃在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。