高二化学第一学期12月份月考试题
高二化学
 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。总分120分。考试时间100分钟。
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。总分120分。考试时间100分钟。
本试卷可能用到的相对原子质量:H 1;C 12;N 14;O 16;Na 23;Al 27;S 32;Cl 35.5;Ba 137
第Ⅰ卷(选择题,共56分)
一、单项选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)
1、下列对“电子云”的认识中,不正确的是 ( )
A、电子云是对核外电子运动状态的形象描述
B、电子云图中每一个点并不表示一个电子
C、H原子核外的一个电子是在一个圆形的轨道上运动的
D、2p电子云和3p电子云的形状相同,但大小不同
2、下列叙述中正确的是 ( )
A.物质的溶解过程,实质上就是其电离过程
B.二氧化硫的水溶液能导电,所以二氧化硫是电解质
C.水难电离,纯水几乎不导电,所以水是极弱电解质
D.1 L 0.2 mol·L-1的H2SO3溶液中含有0.2 mol的H+
3、 某主族元素的原子,M层上有一个半充满的亚层,这种原子的质子数是 ( )
A.只能是7 B.只能是15 C.是11或15 D.是11或13
4、下列四种物质,只能跟NaOH溶液作用,不能跟盐酸作用的是 ( )
A.NaHS B.Na202 C.KHSO4 D.CH3COONH4
5、中和体积相同、pH值相同的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则 ( )
A.V3>V1=V2 B.V3>V2>V1 C.V1>V2>V3 D.V3<V1=V2
6、 标准状况下,向3 mol•L-1的NaOH溶液100mL中缓缓通入4.48L CO2(标况下),充分反应后,溶液中离子浓度大小排列顺序正确的是 ( )
A、(Na+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+)
B、(Na+)>C(CO32-)=C(HCO3-)>C(OH-)>C(H+)
C、C(Na+)> C(HCO3-)>C(OH-)> C(CO32-)>C(H+)
D.(Na+)> C(HCO3-)> C(CO32-)>C(OH-)> C(H+)
7、物质的量浓度相同的强酸和强碱以等体积相互反应后的溶液 ( )
A.一定呈中性 B.一定呈酸性 C.一定呈碱性 D.酸碱性无法判断
8.下列分子中所有原子都满足最外层8电子结构的是 ( )
(1)光气(COCl2) (2)六氟化硫 (3)三氯化磷 (4)二氯化铍
(5)二氧化碳 (6)三氟化硼 (7)五氯化磷 (8)四氟化氙
A、(1)(2)(3)(5) B、(3)(4)(5)(8) C、(1)(3)(5) D、(2)(3)(6)(8)
二.不定项选择题(本题共8小题,每小题4分共32分,每小题有1~2个选项符合题意)
9、原子序数小于18的元素X,其原子最外层中未成对电子数最多,含这种元素的阴离子可能是 ( )
A.XO3- B.XO32- C.XO42- D.XO43-
10、 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
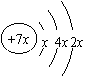 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为 ![]() 。下列比较中正确的是
( )
。下列比较中正确的是
( )
A.原子半径:a>c>d>b B.电负性a>b>d>c
C.原子序数:d>a>c>b D.最高价含氧酸的酸性c>d>a
11、为了除去MgCl2酸性溶性中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再 加入适量盐酸。这种试剂是 ( )
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
12、下列电离方程式书写正确的是 ( )
![]()
![]() A.H2CO3
2H++CO32- B.CaCO3 Ca2++CO32-
A.H2CO3
2H++CO32- B.CaCO3 Ca2++CO32-
![]()
![]() C.HS-+H2O H3O++S2- D.HPO42-+H2O H2PO4-+OH-
C.HS-+H2O H3O++S2- D.HPO42-+H2O H2PO4-+OH-
13、下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Cl-、SO42-
B.Na+、AlO2-、NO3-、CO32-
C.Na+、H+、NO-3、SO42-
D.Na+,SO42-、S2-、Cl-
14、将 0.2 mol·L-1HCN溶液和 0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HCN)<c(CN) B. c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D. c(HCN)+c(CN-)= 0.1 mol·L-1
15、以下关于溶液酸碱性的判断正确的是 ( )
A.pH为7的溶液一定呈中性
B.某溶液中C(H+)>C(OH-),溶液呈酸性
C.某盐溶液呈酸性,该盐一定是由强酸和弱碱生成的盐
D.在25℃,任何物质的水溶液中由水所电离生成的C(H+)·C(OH-)是个常数
16、下列各项中的两个量,其比值最接近2:1的是 ( )
A.常温下pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH4+)与c(SO42-)
B.相同温度下,0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)
![]() C.在密闭容器中,N2+3H2 2NH3,已达平衡时的c(NH3)和c(N2)
C.在密闭容器中,N2+3H2 2NH3,已达平衡时的c(NH3)和c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管内所盛溶液体积
第Ⅱ卷(非选择题卷,共64分)
三、填空题(本题包括5小题,共40分)
17、(6分)下列物质中,能导电的是__________________,属于强电解质的是____________
属于非电解质的是________________(均填序号)
①Cu②液氨③氯水④氯化钠晶体⑤硫酸溶液⑥干冰⑦BaSO4⑧液氧⑨金刚石⑩石墨
18、(4分)某可溶性盐的化学式XmYn(m≠n),将一定量的该盐溶于适量的水中。
(1)若测得溶液的pH为4,则该盐与水反应的离子方程式可能为:
。
(2)若该盐水溶液的pH为10,则该盐与水反应的离子方程式可能为:
。
19、(6分)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_________,F元素原子的电子排布式_________________,
B元素原子的轨道表示式
E元素的原子结构示意图是__________________
(2)E单质在一定条件下与甲反应的化学方程式为 。
20、(16分)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是____________
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外________________________________________________,
如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(6)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________________________, 其中元素_______的第一电离能反常高的原因是
_________________________________________________________。
21.(8分)已知元素的电负性和原子半径等内容一样,也是元素的一种基本性质,下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是:
_________________________________________________________________________
(2)预测Br与I元素电负性的大小关系_________________________________,电负性最小的元素在周期表中的位置是:______________________(放射性元素除外)
(3)习惯上把SrI2作为离子化合物,把BaS作为共价化合物。(电负性Sr=0.95;I=2.66;Ba=0.89;S=2.58)我们把两成键原子的电负性差值用ΔX表示,请找出用ΔX来判断离子键或共价键的数值范围:即当ΔX_______时一般为离子键,当ΔX_______时一般为共价键。试判断AlBr3中化学键的类型是________。
四、实验题(本题包括2小题,共16分)
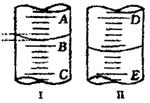
22、(4分)如右图
(1)(2分)图I表示10mL量筒中液面的位置,A与B、B
|
|
 与C刻度相差1mL,如果刻度A为4,量筒中液体体积
与C刻度相差1mL,如果刻度A为4,量筒中液体体积
是 mL。
(2)(2分)图II表示50mL滴定管中液面的位置,如果液面
处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(50-a)mL C.一定大于a mL
D.一定大于(50-a)mL
23、(12分)
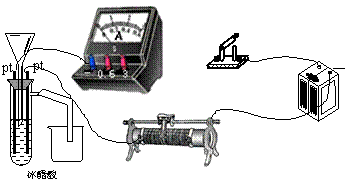 |
为测定冰醋酸在加水稀释的过程中溶液导电能力的变化,某学生用上图所示仪器设计了一个实验。
(1)请将上面所示仪器间没有连接的部分用导线连接起来完成本实验。
(2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1<t2<t3,且在实验全过程中,t2时刻电流计指针偏转为最大)
请据此信息分析,在t1到t2的过程中,溶液中[H+](填“增大”“减小”或“不
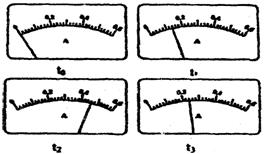 |
变”)__________;继续加水,在t2到t3的过程中,溶液中[H+](填“增大”“减小”或“不变”)___________;请用简要文字解释冰醋酸在稀释过程中[H+]变化的原因_____________
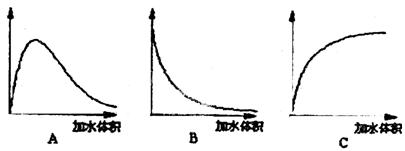
(3)下图中横坐标均表示向一定量冰醋酸中加入水的体积,请判断图中纵坐标的意义并填空。
纵坐标表示(请填选项字母):醋酸的电离程度__________;醋酸的浓度__________;溶液的导电能力__________。
五、计算题(8分)
24、(8分)室温下,有PH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。(已知:lg2=0.3) ,则:
(1)原混合溶液中Ba(OH)2的物质的量浓度是 mol/L,
NaOH的物质的量浓度是 mol/L。
(2)当滴到沉淀不再增加时,溶液的PH 。(设体积可以加和)