高二化学第一学期月考测试题(选修)
时间:100分钟 分值:120分
命题人:万竹青 李慧
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。
可能用到的相对原子质量:![]()
H:1 C:12 N:14 O:16 Na:23 S:32 Al:27 Cl:35.5 Fe:56 Cu:64
第Ⅰ卷(选择题 共56分)
一、单选题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意))。
1、13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt W u thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
2、实现下列变化时,需克服相同类型作用力的是
A.二氧化硅和干冰的熔化 B. 液溴和液汞的气化
C. 食盐和冰的熔化 D. 纯碱和烧碱的熔化
3.下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
4.已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热值为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
5.用惰性电极电解下列溶液一段时间后,加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
6.下列有关化学反应速率的说法中,正确的是
A.100mL 2 mol·L-1盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
7、在密闭容器里,A与B反应生成C,其反应速率分别用![]() 、
、![]() 、
、![]() 表示,已知2
表示,已知2![]() =3
=3![]() 、3
、3![]() =2
=2![]() ,则此反应可表示为
,则此反应可表示为
A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
![]() 8、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
8、可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
二、不定项选择题(本题包括8小题,每小题4分,共32分。每小题有一个或两个选项符合题意。)
9、对配位化合物的说法中不正确的是
A.[Pt(H2O)4]Cl3和[Pt(H2O)2Cl2] ·2H2O·Cl两者互为同分异构体
B.配位化合物中只存在配位键
C.[Cu(H2O)4]2+中的铜离子提供空轨道,水中O提供孤对电子形成配位键
D.[Co(NH3)4Cl2]+的立体构型为正八面体则其同分异构体的数目为3种
10. 现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
11.已知:Fe2O3(s)+3 CO(g)=2 Fe(s)+3 CO2(g);ΔH=-25kJ·mol-1
3 Fe2O3(s)+CO(g)=2 Fe3O4(s)+CO2(g);ΔH=-47kJ·mol-1
Fe3O4(s)+CO(g)=3 FeO(s)+CO2(g);ΔH=+19kJ·mol-1
则CO还原FeO的热化学方程式为
A.FeO+CO=Fe+CO2;ΔH=+11 kJ·mol-1
B.FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH=-22 kJ·mol-1
C.FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH=-11 kJ·mol-1
D.FeO(s)+CO(g)=Fe(s)+CO2(g);ΔH=+22 kJ·mol-1
12.一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6 + 18OH—-14e—= 2CO32—+ 12H2O,
7H2O+(7/2)O2+14e—=14OH-,有关此电池的推断正确的是
A.电解质溶液中氢氧根离子向正极移动
B.放电一段时间后,KOH的物质的量浓度不变
C.通乙烷的电极为负极
D.参加反应的O2和C2H6的物质的量之比为2:7
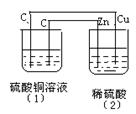 13.如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mol e-。若不考虑溶液体积的变化,下列叙述正确的是
13.如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mol e-。若不考虑溶液体积的变化,下列叙述正确的是
A.相同条件下,两容器产生的气体体积相同
B.(1)、(2)溶液的pH值均减小
C.(1)中阳极电极反应方程式为:4OH-—4e-=2H2O+O2↑
D.(1)中阴极上析出0.64gCu
14.对于反应2SO2+O2 ![]() 2SO3下列判断正确的是
2SO3下列判断正确的是
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速率必定等于O2生成速率的两倍
D.平衡时,SO2的浓度必定等O2浓度的两倍
15.1molX气体和amolY气体在体积可变的密闭容器中发生如下反应:X(气)+aY(气) ![]() bZ(气),反应达到平衡后,测得X的转化率为50%,而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(气),反应达到平衡后,测得X的转化率为50%,而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A、a=1,b=1 B、a=2,b=3
C、a=2,b=2 D、a=3,b=2
![]() 16.在一密闭容器中,反应mA(g) nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
16.在一密闭容器中,反应mA(g) nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
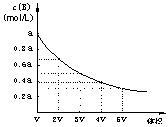 A.物质B的质量分数增加
A.物质B的质量分数增加
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
第Ⅱ卷(非选择题,共64分)
三.填空题
17.(14分)有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道全满或半满。
⑴写出四种元素的元素符号:A_______;B_______;C________;D________
⑵写出C、D两种元素原子核外电子的电子排布式:
C_____________________________;D___________________________
⑶写出B、C种元素单质在一定条件下反应的化学方程式:____________________________
⑷写出B元素单质和氢化物的电子式,单质__________,氢化物___________
18.(6分)已知: 2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
C3H8(g)+5O2(g) = 3CO2(g) +4H2O(l) △H=-2220.0 kJ·mol-1
根据上面两个热化学方程式回答下列问题:
(1)H2的燃烧热△H= .
(2)1molH2和2molC3H8 组成的混合气体完全燃烧释放的热量为 。
(3)现有H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则在混合气体中H2和C3H8的体积比是 。
19.(10分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如 下左图所示。请回答下列问题:
下左图所示。请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是_______________;
(2)银电极为电池的___________极;
X电极上发生的电极反应为____________________;
(3)盐桥中的阳离子移动的方向是_____________________。
20.(14分) 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
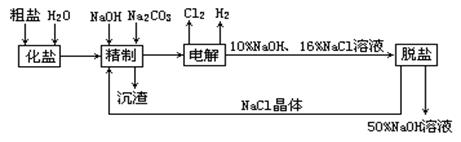
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_____________;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
__________________________________________________________________________。
![]() 钡试剂可以是______
钡试剂可以是______
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
![]() ______
______
a.先加NaOH,后加NaCO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______、冷却、______(填操作名称)除去NaCl。
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为__________________________________。
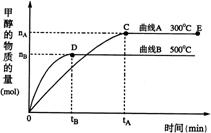 21.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g)
21.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2 H2(g) ![]() CH3OH(g)
CH3OH(g)
不同温度时甲醇的物质的量随时间变化曲线如右图所示。根据题意完成下列各题:
⑴ 反应达到平衡时,平衡常数表达式K = ,升高温度,K值
(填“增大”、“减小”或“不变”)。
⑵ 在500℃,从反应开始到平衡,H2的平均反应速率v(H2)= mol·(L·min)-1
⑶ 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a. 氢气的浓度减小 b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加 d. 重新平衡时n(H2)/n(CH3OH)增大
e. 平衡常数K增大
⑷ 据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
四.计算题(10分)
22.(6分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:
![]() 2SO2 (g) + O2 (g) 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO2 (g) + O2 (g) 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;(2)该温度下的平衡常数;(3)平衡时SO2的转化率。
23.(4分)用石墨作电极点解100mLH2SO4和CuSO4的混合溶液,通电一段时间后,两极均收集到4.48L气体(标准状况),求原混合溶液中Cu2+的物质的量浓度。