高二化学第一学期期末统一练习题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共100分,考试时间90分钟。
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Fe 56 Cu 64
第I卷(选择题 共50分)
一.选择题(本题包括25小题,每小题2分,共50 分。每小题只有一个选项符合题意)
1. 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不属于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加高工厂的烟囱,使烟尘和废气远离地表
2.下列叙述正确的是
A.铜可导电,所以铜是电解质
B.MgCl2在水溶液中和熔融状态下均可导电,它是电解质
C.HCl、H2SO4液态时都不导电,都是非电解质
D.能导电的单质一定是金属
3.进行中和滴定时,需用的仪器事先不应该用所盛溶液润洗的是
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
4.下列变化中,必须加入氧化剂才能发生的是
A. Al→Al3+ B. SO32-→SO2 C. Na+→Na D. NH4+→NH3
5.下列反应既是离子反应,又是氧化还原反应的是
A.氯化钠溶液中滴入硝酸银溶液 B.铁片置于氯化铜溶液中
C. 金属镁在氧气中燃烧 D.氢氧化铝与稀硫酸反应
6.下列各离子方程式中,属于水解反应的是
A.HS-+H2O![]() H2S+OH-
B.HCO3-+H2O
H2S+OH-
B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=== CO32-+ H2O
D.NH3+H2O![]() OH-+NH4+
OH-+NH4+
7. 2005年美国《Science》杂志上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构。这种超原子具有40个最外层电子时最稳定。请预测稳定的Al13所带的电荷为
A.+3 B.+2 C.0 D.-1
8.合成氨时,既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合物中分离出NH3
⑥充入N2或H2 ⑦加催化剂 ⑧减小N2或H2的量
A. ①③⑤ B. ②⑥ C. ②⑤⑧ D. ②③⑦
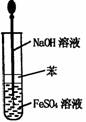 9.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
9.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
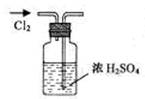
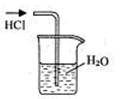
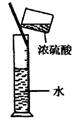
A.干燥Cl2 B.吸收HCl C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
10.已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH-)=1×10-3mol·L-1的碱溶液等体积混和后溶液呈酸性,其原因可能是
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
|
A.pH=1的溶液中:Fe2+、Al3+、HCO3—、MnO4—
B.某无色溶液中:K+、NO3—、Cl-、NH4+
C.含有大量OH-的溶液中:Na+、Cu2+、AlO2—、SO42—
D.常温下由水电离出的c(H+)=10-10 mol·L-1的溶液中:Na+、C1-、S2-、SO32—
12.下列反应的现象描述与离子方程式都正确的是
A.金属镁与稀盐酸反应,有氢气产生: Mg + 2H++ 2Cl— == MgCl2 + H2↑
B.氯化钡溶液与稀硫酸反应,有白色沉淀产生:Ba2+ + SO42— == BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出: Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色:Fe + Fe3+ == 2Fe2+
13.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 2Z(g) 不能说明该反应已达到平衡的标志是
2Z(g) 不能说明该反应已达到平衡的标志是
A.容器内X、Y、Z的物质的量浓度之比为1︰2︰2
B.容器内各物质的物质的量浓度不随时间变化
C.容器内气体的压强不随时间变化
D.单位时间内消耗0.1mol X同时消耗0.2mol Z
14.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是
①Cl2+2KI =I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
15. 氢氧燃料电池是一种新型电池,具有能量转化率高,燃烧产物为水,不污染环境等优点。有关该电池的说法中正确的是
A.通入氢气的电极为负极 B.电流从氢电极流向氧电极
C.反应中电子从氧转移给氢 D.反应中电能转化成化学能
16. 现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中,产生气泡都很慢;把C、D 分别浸入稀硫酸中,产生气泡都很快;把A、B用导线连接时,A上有气泡逸出;把C浸入D的硝酸盐溶液中,C表面有D析出。这四种金属的活动性顺序由强到弱为
A. C>D>B>A B. C>D>A>B
C. D>C>A>B D. D>C>B>A
17.25℃时,水的电离达到平衡:H2O ![]() H++OH—;下列叙述正确的是
H++OH—;下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH—)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
18.将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)![]() 2C(g),若经 2 s(秒)后测得 C 的浓度为
2C(g),若经 2 s(秒)后测得 C 的浓度为
0.6 mol·L-1 ,现有下列几种说法,其中正确的是
A.用物质 A 表示反应的平均速率为 0.6 mol·L-1·s-1
B.用物质 B 表示反应的平均速率为 0.3 mol·L-1·s-
C.2 s 末物质 A 的转化率为70%
D.2 s 末物质 B 的浓度为 0.7 mol·L-1
19.下列溶液中各微粒的浓度关系正确的是
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c[(NH4)2SO4] > c(NH4HSO4) > c(NH4Cl)
B.向NaCN溶液中加入适量HCN,得到的碱性混合溶液:
c(Na+)>c(CN-)>c(H+)>c(OH-)
C.某二元弱酸的酸式盐NaHA溶液中:
c(H+)+c(Na+)=c(OH-)+c(HA—)+c(A2—)
 D.1.0mol· L-1 Na2CO3溶液:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.1.0mol· L-1 Na2CO3溶液:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
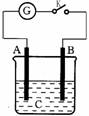
20.如图所示,把A、B插入C的溶液中,闭合电键K后电流仪G的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质
A.A—Ag B—Fe C—HCl B.A—Cu B—Zn C—CuSO4
C.A—Zn B—石墨 C—H2SO4 D.A—石墨 B—Zn C—H2SO4
21. 6.4 g铜与足量的浓硝酸反应(假设硝酸的还原产物只有一种),生成的气体被饱和的氢氧化钠溶液完全吸收,生成NaNO3和NaNO2,则亚硝酸钠的物质的量为
A.0.2mol B.0.3mol C. 0.1mol D.0.5mol
22. 钠、镁、铁的混合物36g,放入一定量20﹪的硫酸溶液恰好反应,将溶液蒸干得无水固体132g,则放出H2在标准状况下的体积为
A.6.72L B.22.4L C.11.2L D.44.8L
23. 把80mL NaOH溶液加入到120mL盐酸中,所得溶液的pH值为2.若混合前NaOH溶液和盐酸的物质的量浓度相同,则该浓度是
A. 0.5mol·L-1 B. 0.1mol·L-1 C. 0.05mol·L-1 D. 1mol·L-1
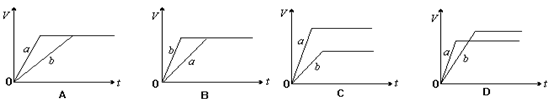
24. 将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液。下图表示产生氢气的体积V与时间t的关系,其中正确的是
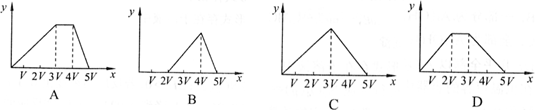
 25. 将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是
25. 将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是
第II卷 (非选择题 共50分)
二.填空题:(本题包括5小题,共44分)
1.(6分)A.配平方程式:(请在短线上填写数字,并完成方程式)
SO32- + MnO4- + H+ — Mn2+ + SO42- + H2O 。
B.在一定条件下,可逆反应:mA+nB![]() pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的
关系是 (填“大于”、“小于”或“等于”);
(2)A、C是气体,增加B的量,平衡不移动,则B为 态(填“气”、“液”或“固”);
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的
方向是 (填“正向”或“逆向”);
(4)加热后,可使C的质量增加,则正反应是 反应(填“放热”或“吸热”)。
2.(6分)有一瓶澄清溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、
Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行以下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,溶液分层,下层呈紫红色;
⑶另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实判断:在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
3.(10分) U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,其在W2中燃烧可生成淡黄色固体。Z的单质在W2中燃烧的产物可使品红溶液褪色。Y的单质也是一种金属,该单质在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为_______________;Y W的电子式为____________;
(2)按顺序写出U、V、W与氢元素形成的10电子氢化物的
化学式 、 、 ;
V、W的氢化物分子结合H+能力较强的是(写化学式)___ _________。
(3)将ZW2气体通人BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________。
4.(12分) A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是由两种元素组成的化合物,D是一种红棕色固体,H的焰色反应呈黄色。
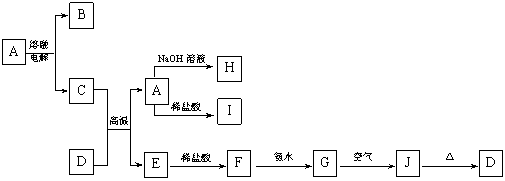 |
请回答下列问题:
(1)B物质的化学式为_________,H物质的名称为________________。
(2)G→J的化学方程式为________________________ ___________。
(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):
_____________ 。
(4)E与碳形成的合金在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:
______________ _ ____。
(5)写出一个满足下列两个条件的置换反应方程式:
①在A——J中选一种单质作为反应物;②生成物之一是具有磁性的氧化物。
_______________ ____ ____。
5.(10分)短周期元素形成的纯净物A、B、C、D、E之间的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
|
|
|
|
|
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的化学式 。
(2)若E是有臭鸡蛋气味的气体硫化氢(其水溶液为二元弱酸),D是既能溶于强酸、又能溶于强碱的化合物。
用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种红棕色气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
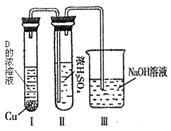 ②有人认为“浓H2SO4可以干燥气体C”。某同学
②有人认为“浓H2SO4可以干燥气体C”。某同学
为了验证该观点是否正确,用右图装置进行实验
(反应前Ⅰ、Ⅱ装置中空气已排尽)。
实验进行一段时间后,浓H2SO4中未发现有气体逸出,
且该溶液变为红棕色,
则你得出的结论是 。
③已知A与物质B及水作用生成D,
写出此反应的化学方程式 。
三.计算题:(6分)
6. Fe和Al是两种重要的金属,将它们按一定的质量比组成混合物。
(1)取一定质量的该混合物,若加入足量的NaOH溶液,生成的气体在标准状况下体积为
n L;若加入足量的稀硫酸,生成的气体在标准状况下体积为m L。则原混合物中Fe的物质的量为 mol(用含n、m的代数式表示)。
(2)取一定质量的该混合物,在纯氧中充分燃烧。向所得产物中加入过量的NaOH溶液,充分反应后将不溶物过滤、洗涤、干燥后称量,测得该不溶物的质量与原混合物的质量恰好相等。则原混合物中Fe与Al的质量比为 。
高二期末统一练习
化学试卷参考答案及评分标准
一.选择题:(每小题2分,共50分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | D | A | B | A | D | B | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | B | A | C | A | A | B | D | A | C |
| 题号 | 21 | 22 | 23 | 24 | 25 | |||||
| 答案 | C | B | C | D | A |
二.填空题:(共44分)
1.(6分)
A.配平:5SO32-+ 2MnO4-+ 6H+== 2Mn2++ 5SO42-+ 3H2O。 (2分)
(系数错不得分,没改写成等号不扣分)
B. (1)小于 (2)固或液 (3)逆向 (4)吸热 (4分,每空1分)
2.(6分)
I- 、Ba2+、NH4+ ;Mg2+、Al3+、Fe3+、SO42-、CO32- ;K+、Na+、Cl-(每空2分)
![]() 3.(10分)
3.(10分)
(1)N≡N Mg2+[ ]2- (4分,每空2分)
(2)CH4 、NH3、H2O ; NH3 (4分,每空1分)
(3)3SO2 + 2H2O +3Ba2++ 2NO3-=== 2NO↑ +3BaSO4↓+4H+ (2分)
4.(12分)
(1)O2 偏铝酸钠 (4分,每空2分)
(2)4Fe(OH)2+2H2O+O2═ 4Fe(OH)3 (2分)
(3)Fe3++3H2O![]() Fe(OH)3+3H+
(2分)
Fe(OH)3+3H+
(2分)
![]() (4)2H2O+ O2+4e-= 4OH-
(2分)
(4)2H2O+ O2+4e-= 4OH-
(2分)
(5)3Fe + 4H2O(g) Fe 3O4 + 4H2 ↑ (2分)
5.(10分)
(1)Na2O2(NaH) (2分)
(2) c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) (2分)
(3)①3NO2+H2O= 2HNO3+NO (2分)
②NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2 (2分,每点1分)
③4NO+3O2+2H2O= 4HNO3 (2分)
三.计算题:(6分)
6.(6分)
(1)![]() (3分)
(3分)
(2)21∶8 (3分)