高二化学第一学期期末统一考试
专业班化学科(选修四、二)试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷1至4页,第Ⅱ卷5至8页。满分100分。考试时间90分钟。
可能用到的原子量:H—1 C—12 N—14 O—16 Mg—24 Si—28 P—31 S—32 Cl—35.5 Fe—56 Cu—64 Ag—108 Ba—137
可能需要的对数值:lg2=0.3 lg3=0.48 lg5=0.7
注意事项:
1、答题前,考生必须将自己的姓名、统考考号、座位号、考试科目用铅笔涂写在答题卡上。
2、第Ⅰ卷共20小题:每小题选出答案后,用铅笔把答题卡上对应的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。第Ⅱ卷则用黑色钢笔(或圆珠笔)按各题要求答在答题卡相应的位置上。
3、考试结束后,将答题卡交回。
第Ⅰ卷(选择题,共45分)
一、选择题(每小题只有一个选项符合题意,每小题2分,共30分)
1、反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.V(D)=0.4 mol / (L·s) B.V (C)=0.5 mol / (L·s)
C.V(B)=0.6 mol / (L·s) D.V (A)=0.15 mol / (L·s)
2、对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g)
+ 6H2O(g),下列叙述正确的是
4NO(g)
+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4 V正(O2) = 5 V逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2 V正(NH3) = 3 V正(H2O)
3、有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
A.V3>V2>V1 B.V3=V2=V1
C.V3>V2=V1 D.V1=V2>V3
4、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
5、可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变 B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等 D.反应容器内的气体总物质的量不随时间变化
6、强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH—(aq)=H2O(1);⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是
A.⊿H1>⊿H2>⊿H3 B.⊿H1<⊿H3<⊿H2
C.⊿Hl<⊿H2<⊿H3 D.⊿H1>⊿H3>⊿H2
7、氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会
A.偏低1% B.偏高1% C.无影响 D.偏高0.1%
8、下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
9、有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
10、下列离子组能够在溶液中大量共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
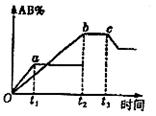
![]() 11、有反应A2+B2
2AB;在温度和压强可变条件下。产物AB的生成情况如图所示:a为500℃,b为300℃时情况,c为300℃ 时从时间t3开始向容器中加压的情况,则下列叙述正确的是
11、有反应A2+B2
2AB;在温度和压强可变条件下。产物AB的生成情况如图所示:a为500℃,b为300℃时情况,c为300℃ 时从时间t3开始向容器中加压的情况,则下列叙述正确的是
A.AB为气体,A2、B2中必有一种为非气体;正反应吸热
B.AB为气体,A2、B2中必有一种为非气体;正反应放热
C.AB为固体,A2、B2中必有一种为非气体;正反应放热
D.A2、B2、AB均为气体;正反应吸热
12、同温下,有甲、乙两瓶醋酸稀溶液,测得甲pH=a,乙pH=a+l,下列推断正确的是
A.物质的量浓度c(甲)是c(乙)的10倍
B.溶液中的c(OH-)甲是乙的10倍
C.由水电离产生的c(H+)乙是甲的2倍
D.与等量的NaOH反应消耗甲、乙两酸的体积v(乙)>10V(甲)
13、下列措施或方法在化工生产中不会被采用的是
A.用双氧水制备氧气 B.在400-500℃下进行SO2的接触氧化
C.在20Mpa压力下合成氨 D.将合成氨与制纯碱联合生产
14、下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
15、采用循环操作可提高原料的利用率,在下列工业生产中,没有采用循环操作的是
A.硫酸 B.合成氨 C.硝酸 D.氯碱
二、选择题(本题包括5小题,每小题3分,共15分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,但只要选错一个,该小题就为0分)
16、下列说法正确的是
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.物质燃烧一定是放热反应
C.放热的化学反应不需要加热就能发生
D.吸热反应不加热就不会发生
17、常温时,0.1mol/LHA溶液的pH>1,0.1mol/L BOH溶液中c(OH-): c(H+)=1012,将这两种溶液等体积混合,以下离子浓度关系判断正确的是
A.c(H+)<c(OH-)<c(A-)<c(B+)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(A-)= c(B+)>c(H+)=c(OH-)
D.c(H+)+ c(B+)= c(A-)+c(OH-)
18、用来表示可逆反应2A(g)+B(g)![]() 2C(g);△H < 0的正确的图象为
2C(g);△H < 0的正确的图象为
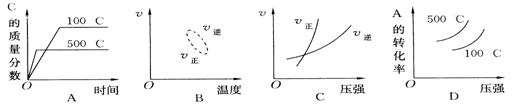 |
19、在NaCl溶液中含有少量的Na2S,欲将S2—除去,可加入( )
A.稀盐酸 B.AgCl C.NaOH D.KCl
20、下列说法正确的是
A.增大压强,化学反应速率一定增大,平衡向正反应方向移动
B.放热反应一定是自发反应,吸热反应一定是不自发反应
C.向已达平衡状态的平衡体系中加入反应物一定会导致平衡正向移动
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
第Ⅱ卷(非选择题,共55分)
三.(本题包括4小题,共26分)
21、(6分) 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为__________________________
22、(6分)求25℃时以下溶液的pH
(1) pH=10和pH=12的两种NaOH溶液等体积混合后,pH= ____________
(2) pH=9的NaOH溶液稀释到原来的1000倍后,pH___________。
(3) pH=12的NaOH和pH=1的HCl等体积混合后,pH= ____________
23、(6分)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)![]() CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)
![]() CO2+H2
CO2+H2
(1)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂? ,
A.氢氧化钠溶液 B.氨水 C.石灰水或石灰乳
该物质吸收CO2后的产物用途之一是 。
(2)已知500℃该反应的平衡常数为1.44,若CO和H2O(g)的起始浓度均为2.0mel/L,求上述反应达到平衡状态时CO的转化率。`
24、(8分)酸性锌锰干电池工作时的反应式为:Zn+2NH4Cl=ZnCl2+2NH3↑+H2↑
下面是一种废干电池的综合利用方案。
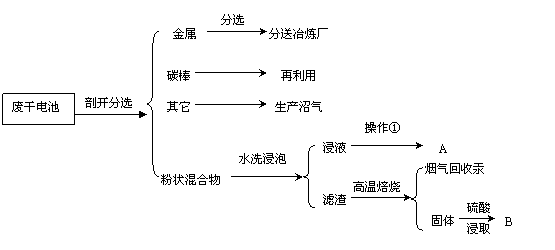
 (1)酸性锌锰干电池工作时正极的电极反应式为
。
(1)酸性锌锰干电池工作时正极的电极反应式为
。
(2)上述回收过程中得到的A主要成份是 ,操作①的名称是 。
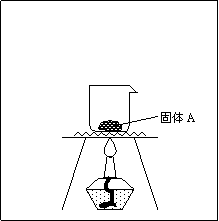
(3)要将A分离成为单一成份的物质,可用实验室常见仪器组合成一套装置来实现,试补画出所缺仪器并标明仪器中所盛物质。

四.(本题包括1小题,共9分)
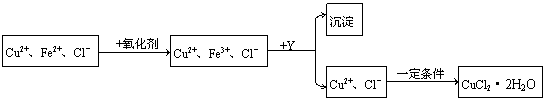
25、CuCl2溶液中含有少量杂质FeCl2,为制备纯净的晶体CuCl2·2H2O,拟定实验步骤如下:
 下面的数据可能对你解答本题有帮助。
下面的数据可能对你解答本题有帮助。
已知:溶度积:Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)2]= 8.0×10-16
Ksp[Fe(OH)3]= 4.0×10-38
(1)第一步将Fe2+氧化为Fe3+最适宜的氧化剂是( )
A.K2Cr2O7 B. NaClO C. H2O2 D. KMnO4
(2)加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可选用下列物质中的哪些?( )
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
E .Cu2(OH)2CO3 F.Cu
(3)当溶液中c(Fe3+)<1.0×10-5mol/L时可以认为沉淀完全,计算此时溶液中的c(OH-)。此时所得沉淀中是否有Cu(OH)2(假定溶液中c(Cu2+)=0.2mol/L)?
(4)从Fe3+沉淀完全后的溶液中获得CuCl2·2H2O晶体时应控制的一定条件是
。
五.(本题包括2小题,共20分)
26.(10分)气体混合物中各组分所占比例常用该气体的分压表示,下图是SO2在水中溶解度与SO2分压关系图。
![]()
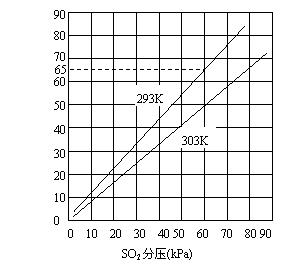

(1)上图反映SO2气体在水中溶解度大小与哪些因素有关?这些因素如何影响SO2气体的溶解度?
(2)长途运输鲜活水产品时可用充有富氧空气的橡皮袋为容器,解释充入富氧空气的作用。
![]() (3)上述图表中SO2的溶解度是以SO2计算的各种形体的总浓度,已知293K下SO2在水中存在如下反应与平衡:
(3)上述图表中SO2的溶解度是以SO2计算的各种形体的总浓度,已知293K下SO2在水中存在如下反应与平衡:
![]() ① SO2+xH2O
① SO2+xH2O![]() SO2.xH2O
SO2.xH2O
② SO2.xH2O H++HSO3- +(x-1)H2O K1=1.44×10-2
![]() HSO3- H
++SO32- K2=1.02×10-7
HSO3- H
++SO32- K2=1.02×10-7
试计算SO2分压为60kPa时其水溶液的pH(保留两位小数)
(已知lg1.1=-0.96 lg0.12=-0.92 lg0.13=-0.88)
27.(10分)我国化学家侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
 |
(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
化学科参考答案及评分标准
一、选择题:(每小题2分,共30分)
1、B 2、A 3、C 4、B 5、C 6、D 7、C
8、C 9、B 10、D 11、B 12、D 13、A 14、D 15、A
二、选择题:(每小题3分,共15分)
16、A B 17、AD 18、AC 19、A B 20、D
三、本题包括4个小题,共26分。
21、每个方程式各两分,其中反应式书写无错得1分,分子式错、反应物状态错该项均不得分;反应热值计算正确得1分。
(1)CH3OH(l)+![]() O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
O2(g)→CO2(g)+2H2O(l) ΔH=–725.76kJ·mol-1
(2)N2(g)+2O2(g)=2NO2(g) ΔH=67.8kJ·mol-1
(3) N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1
22.(6分,每小题2分)
(1) 11.7 (2) ≈7 (3) 1.3
23、(6分)
(1)B (1分) 化肥(或肥料,或点心膨松剂)(2分)
(2)设反应在800℃达平衡时CO的转化浓度为xmol/L
CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
起始浓度 2 2 0 0
转化浓度 x x x x
平衡浓度 2-x 2-x x x
 则有
则有![]() (2分)
(2分)
x≈1.09 CO%=54.5% (1分)
24、(8分)
(1)2NH4++2e-=2NH3↑+H2↑(2分)
(2)NH4Cl和ZnCl2,(2分) 重结晶(1分)(3)(3分,绘图2分,标名称1分)
四、本题包括1小题,共9分)
25:
⑴ C (1分) ⑵ CDE (2分,全对得2分,不完整得1分,有错误不得分)
⑶设此时溶液中的OH-浓度为xmol/L,则有:
c(Fe3+)×x3≤ 4.0×10-38
x3≤ 4.0×10-33
x≤ 1.6×10-11 (2分)
对溶液中的铜离子,此时有:
Qc=0.2×(1.6×10-11)2=5.12×10-23< Ksp[Cu(OH)2]=2.2×10-20(1分)
所以此时没有氢氧化铜形成。(1分)
⑷ 将滤液加热在较低温度下蒸发析出晶体,同时通以氯化氢气体防止氯化铜水解。(2分)
五、本题包括2小题,共20分
26、
(1)气体分压和温度;(1分)分压越大气体溶解度越大(1分),温度越高气体溶解度越小。(1分)
(2)富氧空气中氧气分压大于空气中氧气分压,水中可以溶解更多氧气,有利于水产品的存活。(2分)
(3)解:查图可知SO2分压为60kPa时溶解度为65g/1000g水,由于H2SO3的二级电离常数比一级电离常数小很多,可忽略,溶液pH以一级电离常数计算。(1分)
c(H2SO3)=1.0mol/L
设溶液中H+浓度为x
SO2.xH2O![]()
![]() H++HSO3-
+(x-1)H2O
H++HSO3-
+(x-1)H2O
1-x x x
1.44×10-2=x2/(1-x) (1分)
x≈0.12mol/L (2分)
pH=0.92 (1分)
27.(1)联合制碱法或侯德榜制碱法
化肥或电解液或焊药等(其他合理答案均给分)
(2)NH3 + CO2 + H2O + NaCl → NH4Cl + NaHCO3↓
或 NH3 + CO2 + H2O → NH4HCO3 NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl
(3)CO2
(4)Ⅰ 过滤
(5)稀硝酸和硝酸银溶液
(6)a、c