高二化学第一学期期末考试试卷
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。总分100分,考试时间90分钟。
2.考生在答题前务必将密封线内的项目填写清楚;Ⅰ卷答案请填写Ⅱ卷卷首的答案栏内,考试结束后只将Ⅱ卷交回。
可能用到的相对原子质量:H—1 C-12 N—14 O—16 S—32 Cl—35.5
K—39 Ca-40 Fe—56 Cu—64
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.下列气体不会造成大气污染的是
A.氮气 B.二氧化硫 C.一氧化碳 D.一氧化氮
2.下列物质属于纯净物的是
A.黄铜 B.青铜 C.钢 D.铁
3.下列金属只能与高温水蒸气反应而不能与热水反应的是
A.Ca B. Mg C. Fe D.Cu
4.在1 L 1 mol / L的氨水中
A.含1 mol NH3分子
B.含NH3和NH4+之和为1 mol
C.含NH3、NH4+ 、NH3·H2O之和为1 mol
D.含NH3·H2O为1 mol
5.下列方程式属于水解反应的是
A.H2O+H2O ![]() H3O++H+
H3O++H+
B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=H2O+CO32-
D.CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
6.pH=1的H2SO4溶液中由水所电离出的c(H+)为
A. 0.1 mol / L B.10-7 mol / L
C.10-14 mol / L D.10-13 mol / L
7.将下列固体在隔绝空气的密闭容器中用酒精灯加热,在加热的过程中,发生了化学反应,但冷却后又生成为原来物质的是
A.碘片 B.氯化铵 C.碳铵 D.碳酸钠
8.五氧化二磷不仅是一种强干燥剂,而且有很强的脱水性,向浓硝酸中加入过量的P2O5,能生成一种含氮化合物M,则M最可能是
A. N2 B.NO2 C.NO D.N2O5
9.以下关于化学反应速率的论述中正确的是
A.化学反应速率可用某时刻生成物的物质的量来表示
B.同一反应中,用反应物或生成物表示的化学反应速率数值相同
C.化学反应速率是指反应进行的时间内反应物浓度的减少或生成物浓度的增加
D.可用单位时间内氢离子物质的量浓度变化来表示NaOH和H2SO4的反应速率
10.下列说法正确的是
A.强电解质溶液一定比弱电解质溶液的导电性强
B.电解质一定能导电
C.强电解质的溶解度一定大,弱电解质的溶解度一定小
D.弱电解质在溶液中一定存在电离平衡
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
11.pH相同的醋酸和硫酸,分别跟适量的碳酸钠溶液反应,在同温同压下,放出二氧化碳气体的体积是
A.一样多 B.醋酸多 C.硫酸多 D.无法比较
12.在一定温度下的固定容积的密闭容器中,反应
A2(g)+B2(g)![]() 2AB(g), 达到平衡的标志是
2AB(g), 达到平衡的标志是
A.单位时间内生成n mol A2,同时生成n mol AB
B.容器内的总压强、密度和平均相对分子质量均不随时间变化
C.容器内A2、B2、AB的物质的量之比1∶1∶2
D.单位时间内生成2n mol的AB同时生成n mol的B2
13.由铜、锌和稀硫酸组成的原电池,在工作过程中,电解质溶液的pH
A.不变 B.先变小后变大 C.逐渐变大 D.逐渐变小
14.水是一种极弱的电解质,在室温时,平均每n个水分子中有1个分子发生电离,则n值为
A.1×10-14 B.55.6×107 C.107 D.55.6
15.已知一种pH=3的酸和一种pH=11的碱等体积混合后溶液呈酸性,其原因可能是
A.浓的弱酸溶液和稀的强碱溶液反应
B.浓的强酸溶液和稀的强碱溶液反应
C.等物质的量浓度的强酸溶液和弱碱溶液反应
D.生成了一种强酸弱碱盐
16.下列物质分别与等体积等浓度的稀硫酸恰好完全反应:
① Mg ② MgO ③ Mg(OH)2 ④MgCO3
所得溶液中溶质的物质的量浓度相等的是
A.①②③④ B.②③ C.②④ D.②③④
17.某无色透明溶液能与Al反应析出H2,则此溶液中可能大量存在的是
A.OH—、Ba2+、Cl—、AlO2— B.H+、Mg2+、NO3—、Na+
C.H+、Cu2+、SO42—、K+ D.H+、Cl-、AlO2—、Mg2+
18.已知Fe3+在pH=3.7左右水解完全,现有pH=2的MgCl2溶液中含杂质FeCl3,为除去杂质可加入的试剂是
A. CaO B.NaOH C.MgO D.Na2CO3
19.用含a molAlCl3的溶液和b molNaOH的溶液混和,可得沉淀的物质的量为
①amol ②bmol ③0.2amol ④b/3mol
⑤(4b-a)mol ⑥(4a-b)mol ⑦0mol
A.①② B.①④⑤ C.①③④⑤⑦ D.①③④⑥⑦
20.阿波罗宇宙飞船上使用的是氢-氧燃料电池,其电极总反应式为:
2H2+O2=2H2O;电解质溶液为KOH溶液,下列叙述正确的是
A.此电池能见到浅蓝色火焰
B.H2为正极,O2为负极
C.工作时电解液的pH不断增大
D.电极反应为:
负极 2H2+4OH--4e-=4H2O
正极 O2+2H2O+4e-=4OH-



高二化学
第II卷(非选择题,共50分)
注意事项:
1.用钢笔或圆珠笔直接答在试卷中。
2.答卷前将密封线内的项目填写清楚。
| 题号 | 一 | 二 | 三 | 四 | 五 | Ⅱ卷总分 |
| 得分 |
Ⅰ卷答案栏:(1—10小题目各2分;11—20小题目各3分,共50分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | ||||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 |
三、本题包括2小题,共18分
21.(6分)下面是某学生用已知浓度的盐酸溶液测定未知浓度的NaOH溶液的部分操作,错误的是 ,在其错误的操作中,使滴定结果一定偏大的是 。
A.取一锥形瓶,用待测NaOH溶液润洗两次后装入25 mL待测NaOH溶液
B.加入几滴石蕊试液作指示剂
C.取一支酸式滴定管,洗涤干净后直接往其中注入标准盐酸溶液
D.滴定时,两眼注视滴定管内盐酸溶液液面下降,直至滴定终点
22.(12分)浓硫酸与甲酸共热可发生反应,生成一氧化碳:
HCOOH ![]() CO↑+H2O
CO↑+H2O
用一氧化碳还原铁的某种氧化物(FexOy)的装置如下图:
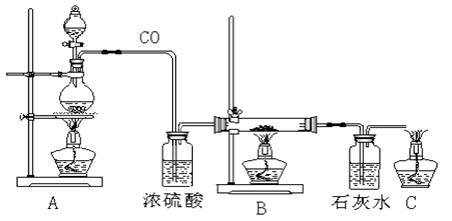
硬质玻璃管B中盛有FexOy粉末。试回答:
⑴B中FexOy与CO作用的化学方程式__________________________。
⑵C装置的作用是__________________________________________。
⑶尾气点燃在何时进行______________________________________。
⑷本实验需用到A、B、C三个酒精灯,点燃酒精灯的先后顺序是(填A、B、C等编号)____________。
⑸用CO还原0.58 g FexOy,将生成的气体全部通过足量的澄清石灰水后,得到1.0 g 白色沉淀,则FexOy中的x值为_____ ___,y值为___ _____。
四、本题包括2小题,共22分
23.(6分)请完成并配平反应:
KMnO4+ H2S+ H2SO4= K2SO4+ MnSO4+ S↓+
该反应中电子转移总数是 ,当反应中有80 g硫析出时,有 mol还原剂被氧化。
24.(16分)下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末,K是一种几乎不溶于水的白色胶状物,具有一定的净水作用(反应条件及部分反应物、产物未全部说明),根据图示转化关系填写下列空白:
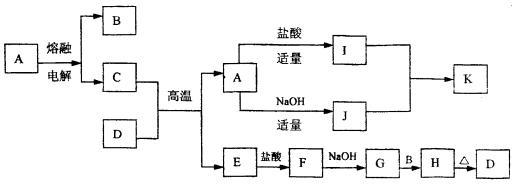
(1) 写出下列物质的化学式A ,E ,G 。
(2) C与D的混合物通常称 (填名称)。
(3) 写出下列化学方程式或离子方程式
A+NaOH® J的离子方程式为 。
G+B ® H的化学方程式
。
J的水溶液与CO2反应的离子方程式:
。
(4) I的溶液通常显酸性,请用离子方程式解释原因为:
。
五、本题包括2小题,共10分
25.(4分)将0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),5 min末时已生成0.2 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
nZ(g)+2W(g),5 min末时已生成0.2 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
(1) 以X的浓度变化来表示化学反应速率为多少?
(2) 反应中Z气体的化学计量数n的值是多少?
26.(6分)将一定量的氧化铜加入到100.0ml2.5mol/L 的稀硫酸中,待其完全溶解后,再向蓝色溶液中加入19.6g铁粉,经搅拌、过滤、洗涤、干燥等操作,最后得到的固体质量为18.4g 。
(1) 通过计算说明干燥后得到的固体是什么物质?
(2)求原氧化铜的质量
高二化学试题参考答案及评分标准
说明:所提供答案仅供参考,考生给出其他答案,只要合理,即可比照给分。
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答 案 | A | D | C | C | D | D | B | D | D | D |
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答 案 | D | D | C | B | A | C | A | C | D | D |
(其中1—10小题各2分,11—20小题3分,此题目共50分)
三、(本大题共18分)
21. (6分) A BC D (每项1分) AC (每项1分,见错不得分)
22.(12分)(1)FexOy+yCO![]() xFe+yCO2;
(2分)
xFe+yCO2;
(2分)
(2)使尾气中的CO燃烧生成CO2,以防污染空气和中毒 (2分)
(3)点燃A处酒精灯使CO排净装置内空气,经验纯后点燃C处酒精灯。(2分)
(4) A 、C、 B ; (见错不得分) (2分)
(5) 3、4 (4分)
四、(本大题共22分)
23. (6分) 2,5,3—1,2,5,8,H2O;(配平2分) 10;(2分) 2.5 (2分)
24.(16分) (1) Al2O3;Fe;Fe(OH)2 (6分)
(2) 铝热剂 (2分)
(3) Al2O3+2OH-=2AlO2-+H2O; (2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (2分)
(4) Al3++3H2O![]() Al(OH)3+3H+
(2分)
Al(OH)3+3H+
(2分)
五、(本题共10分)
25.(4分) (1) 以W浓度来表示的化学反应速率为
u(W)=![]() =0.02 mol / (L·min)
=0.02 mol / (L·min)
根据![]() =
=![]() ,
,
u(X)=0.02 mol / (L·min)×![]() =0.03 mol / (L·min)
(2分)
=0.03 mol / (L·min)
(2分)
(2) 根据![]() =
=![]()
n=![]() ×2=
×2=![]() ×2=1
(2分)
×2=1
(2分)
26. (6分)
(1) 由于 n(H2SO4)=0.1×2.5=0.25 (mol)
则 最多耗铁的质量 0.25×56=14 <19.6g
铁过量,最后得到的固体为铜和铁的混合物 (2分)
(2)由 CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=Cu+FeSO4
由于铁过量
故 最后18.4g固体中含Fe 19.6—14=5.6 g
含Cu 18.4—5.6=12.8g
因而 CuO的质量为 80×12.8 /64 =16.0g (4分)
高 二 化 学
第Ⅱ卷(共52分)
三、21.(6分) (1) , 。
22.(12分)(1) ,
(2) 。
(3) 。
(4) 。 (5) , 。
四、23.(6分) 。
24.(16分)(1) A E G 。(2) 。
(3) 。
。
。
(4) 。
25.(4分)
26.(6分)