高二化学第一学期期末考试试卷
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。总分100分,考试时间90分钟。
2.考生在答题前务必将密封线内的项目填写清楚;Ⅰ卷答案请填写Ⅱ卷卷首的答案栏内,考试结束后只将Ⅱ卷交回。
可能用到的相对原子质量:H—1 C-12 N—14 O—16 S—32 Cl—35.5
K—39 Ca-40 Fe—56 Cu—64
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.据某媒体报道:德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图。从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高。其原因是这些地区的( )
A.硝酸工业发达
B.雷雨天气较多
C.机动车辆过多
D.燃料以煤为主
2.为了检验某FeCl2溶液是否变质,可向溶液试样中加入( )
A. NaOH溶液 B. 铁片
C. KSCN溶液 D.石蕊试液
3.下列各组金属最适合用H2或CO把它从化合物中还原出来的是( )
A. Cu、Na B. Al、Fe
C. Fe、Cu D.Mn、Ag
4.正在燃烧着的镁条,放入下列气体时,不能继续燃烧的是( )
A.CO2 B. Cl2 C. O2 D. Ne
5.下列说法不正确的是( )
A.凡是铵盐均能与苛性钠共热产生氨气
B.碳酸氢铵受热分解产生的气体以碱石灰干燥后可得到纯净的氨气
C.氨气溶于水后,水溶液中主要以铵离子形式存在
D.若无催化剂的作用,氨的氧化产物一般为氮气
6.对已达化学平衡的下列反应:2X(g)+Y(g)![]() 2Z(g),当其它条件不变减小压强时,对反应产生的影响是( )
2Z(g),当其它条件不变减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
7.温度相同、浓度均为0.2 mol/L的 ①(NH4)2SO4、 ②NaNO3、 ③NH4HSO4、 ④NH4NO3、⑤CH3COONa溶液,它们的pH值由大到小的排列顺序是( )
A.③①④②⑤ B.①③⑤④② C.③②①⑤④ D.⑤②④①③
8.相同物质的量的镁、铝、铁分别与足量的稀硫酸反应,生成相同状况下氢气的体积比为( )
A. 2:3:2 B. 1:1:2 C.1:2:2 D.3:4:2
9.两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中,乙则用甲用过的碱式滴定管另取碱液于刚用水洗过且存有蒸馏水珠的锥形瓶中,其它操作及读数全部正确。下列说法中正确的是( )
A.甲操作正确 B.乙操作有误
C.甲测定数值一定比乙小 D.乙实际测得值较准确
10.某黄色溶液中含有下列离子:K+、NH![]() 、Fe3+、Ba2+、SO
、Fe3+、Ba2+、SO![]() 、HCO
、HCO![]() 、Cl-、S2-中的两种或多种,为检验其成分,先对溶液进行初步分析。则下列判断中,不正确的是( )
、Cl-、S2-中的两种或多种,为检验其成分,先对溶液进行初步分析。则下列判断中,不正确的是( )
A.溶液中存在Fe3+
B.溶液中可能存在大量Ba2+
C.溶液中不存在大量HCO![]() 和S2—
和S2—
D.溶液可能呈强碱性
11.下列方程式书写正确的是( )
A. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.H2SO3的电离方程式H2SO3![]() H++HSO3-
H++HSO3-
C. NaHSO4在水溶液中的电离方程式:NaHSO4=Na++ HSO4-
D.NaHCO3的电离方程式:NaHCO3=Na++H++CO3-
12.向a mL浓度为0.2 mol/L的AlCl3溶液中加入金属钠,完全反应后,恰好只生成NaCl和NaAlO2的溶液,则加入钠的物质的量是( )
A. 2.5a×10-4mol
B. 4a×10-4mol
C. 7.5a×10-4mol
D. 8a×10-4mol
13.常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
A.pH>7,且![]()
B.pH>7,且![]()
C.pH=7,且![]()
D.pH<7,且![]()
14.一定量的铜与一定量的浓硝酸恰好完全反应,产生NO、NO2两种气体(不考虑2NO2![]() N2O4),已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为(
)
N2O4),已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为(
)
A.2∶1 B.1∶2 C.2∶3 D.1∶1
15.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
![]() x Mg +
Mo3S4 MgxMo3S4
x Mg +
Mo3S4 MgxMo3S4
在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移 B.正极反应为:Mo3S4 +2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:x Mg-2xe- = x Mg2+
16.在硝酸铁溶液中,加入a g铜完全溶解后,又加入b g铁,充分反应后有c g残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中肯定不含有Fe3+
B.残余固体肯定不含有铁
C.最后得到的溶液中肯定不含有Cu2+
D.残余固体中肯定不含有铜
高二化学答题卷
注意事项:
1.用钢笔或圆珠笔直接答在试卷中。
2.答卷前将密封线内的项目填写清楚。
| 题号 | 一 | 二 | 三 | 四 | 五 | Ⅱ卷总分 |
| 得分 |
Ⅰ卷答案栏:(小题每各3分,共48分)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | ||||||||
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答 案 |
第Ⅱ卷(共52分)
二、填空题(本题包括4小题,共21分)
17.(5分) 锌和极稀的HNO3发生反应生成硝酸铵,其变化可表述为:
___Zn + ___HNO3(极稀) =___Zn(NO3)2 +___NH4NO3 +___
(1)请配平并填写空白;
(2)硝酸在反应中显示出来的性质是 (填编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1 mol NH4NO3,则转移的电子的物质的量为 mol。
18.(3分)将相同质量的镁条分别放在①O2中、②N2中、③空气中、④CO2中燃烧,其中将上述燃烧后所得固体的质量按由小到大排列的顺是 。
19.(8分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:
![]() A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
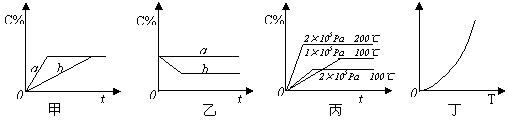 |
⑴若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则_________曲线表示无催化剂时的情况,原因是_____________________________________________________;
⑵若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则____________________________曲线表示恒温恒容的情况,原因是________________________________________________________________;
⑶根据丙图可以判断该可逆反应的正反应是_______热反应,计量数x的值_________;
⑷丁图表示在某固定容积的密闭容器中上述可逆反应达到平衡后某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是 ,原因为________________________________________。
20.(5分)⑴常温下,0.1mol/L的醋酸和0.1mol/L的盐酸各100 mL分别与足量的锌粒反应,产生的气体体积前者比后者________________________。
⑵常温下,0.1mol/L的醋酸和pH=1的醋酸各100 mL分别与足量的锌粒反应,产生的气体体积前者比后者________________________。
⑶在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)________________________。
A.3~5之间 B.5 C.5~7之间 D.7
⑷25℃时,向0.1mol/L醋酸溶液中加入少量的醋酸钠晶体,当晶体溶解后测得溶液的pH将________________________。
A.增大 B.减小 C.不变 D.无法确定
⑸室温下,向0.1mol/L的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入________________________试剂。
A.硫酸钠溶液 B.醋酸钠晶体 C.少量硫酸铜溶液 D.硝酸钠溶液
三、推断题(本题1小题,共9分)
21.A~K是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已经略去)。已知A是一种高熔点的化合物,D是一种红棕色的固体,H的焰色反应呈黄色。
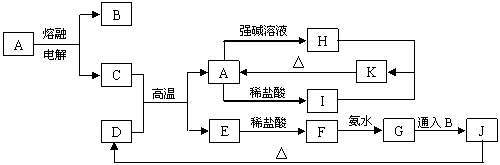 |
请回答下列问题:
(1)A物质的化学式为 。
(2)C与强碱溶液反应的离子方程式为 ;H和I反应生成K的离子方程式为 ;
(3)G 生成J的化学方程式为_______________________________________________。
(4)D与盐酸反应的离子方程式为 ,常温下所得溶液的pH______(填大于、小于、等于)7,其原因是(用离子方程式表示)___________________________。
(5) 不纯的E在潮湿的空气中易发生电化学腐蚀,其负极发生的电极反应式是_____________________;正极发生的电极反应式是______________________________。
四、实验题(本题2小题,共12分)
22.(6分)氨跟氧化铜反应可以制取氮气,而氮气跟镁在高温下可得氮化镁, 氮化镁与水反应生成氢氧化镁和氨气。
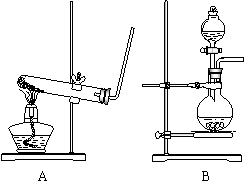 右图装置A、装置B都可用作实验室制氨气,
右图装置A、装置B都可用作实验室制氨气,
(1)若选取A装置,则制氨的化学方程
式 ;
(2)选取B装置,则可用
和 两种常用药品来制取。
(3)以下流程图是某同学提出的制氮化镁
的一种实验方案图 (实验前系统内空气已排除)
B中产生的气体 →碱石灰→浓硫酸 →CuO粉末(灼热)→镁粉(高温)→(以下从略)
该方案未能制得氮化镁,你认为其原因是 ;
请你仿照上述形式,在以下流程图中设计一个实验方案(方框内不一定填满)制氮化镁
B中产生的气体 → → → → →(以下从略)
23、(6分)某课外研究小组,利用下列实验装置来完成“铁与水蒸气的反应”的实验,
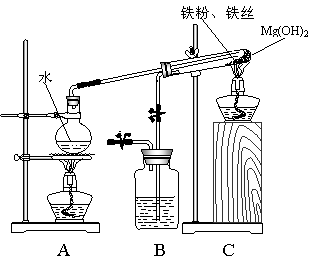 并检验气体产物。大试管中盛放是:
并检验气体产物。大试管中盛放是:
(1)Mg(OH)2 ,在受热分解后
能产生350℃的水
蒸气,使得反应获得足够高的热量;
(2)铁粉和铁丝网,铁丝网的作
用是为了加大铁粉与水蒸气的接触
面,并加大传热的效率。该实验能
加快反应的速率,提高实验的成功
率。
请你回答下列问题:
(1)写出铁与水蒸气反应的化学
方程式______________________。
(2)装置B中盛放的是___________
____,其作用是_____________________________。
(3)在实验进行前必须进行的操作是___________________;为了检验导管口b处的气
体,在检验前必须进行的操作是____________;
(4)实验完毕后的操作是____________________________________________________。
四、计算题(本题1小题,共10分)
24.(10分) 将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是______________;
②原硝酸溶液的物质的量浓度为:________________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
高二化学参考答案
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答 案 | C | B | D | D | C | B | D | A |
| 题 号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
一.选择题 (每题各3分共48分)
二.填空题 (共21分)
17.(共5分)
(1) 4、10、4、1、3 H2O (共3分)
(2) ④ (3) 0.8 (各1分)
18. (共3分)
②<③<①<④ (共3分)
19.(共5分)
⑴ b b曲线表示的反应速率慢 (各1分)
⑵ a 在恒温恒容条件下,充入He平衡不移动 (各1分)
⑶ 吸热 >2 (或 ≥3) (各1分)
⑷ 反应物的转化率(或产物百分含量) (各1分)
⑸ 随温度升高平衡向正向移动 (各1分)
20.(共5分)
⑴ 相等 ⑵ 少 ⑶ C ⑷ A ⑸ A B (各1分)
三.推断题(共9分)
21.⑴ AL2O3 (1分)
⑵ 2Al +2OH—+2H2O=2AlO2-+3H2↑ (1分)
3AlO2- +Al3++4H2O=4Al(OH)3↓ (1分)
⑶ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (1分)
⑷ Fe2O3+6H+ = 2Fe3++3H2O (1分)
小于 Fe3++3H2O = Fe(OH)3+3H+ (各1分)
⑸ Fe-2e- = Fe2+ 2H2O+4e- +O2=2OH- (各1分)
四.实验题(共12分)
22.(共6分)
(1)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O (2分)
CaCl2+2NH3↑+2H2O (2分)
(2)浓氨水;生石灰(或氢氧化钠固体等) (各1分)
(3)氨气已被浓硫酸吸收,无法再与氧化铜反应 (1分)
B中产生的气体 →碱石灰→CuO粉未 →浓硫酸→镁粉(高温)→(以下从略) (1分)
23.(共6分)
(1)3Fe+4H2O(g)![]() Fe3O4 +4H2 ↑
(1分)
Fe3O4 +4H2 ↑
(1分)
(2)浓硫酸;干燥氢气 (各1分)
(3)装置的气密性检查;检验氢气的纯度。 (各1分)
(4)先熄灭A处酒精灯,然后关闭止水夹a,最后熄灭C处酒精灯。
(1分)
五.计算题(共10分)
22.⑴ ① Fe(NO3)2 (2分)
② 0.8 (3分)
⑵ ① FeSO4 (2分)
② 5.0 (3分)