高二化学第一学期期末考试试题
命题:陈福天 2008.1.25
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。全卷满分100分,考试时间90分钟。
相对原子质量:H 1 C 12 O 16 S 32 Ba 137
第Ⅰ卷 选择题(共40分)
一、选择题(本题包括20小题,每题2分,共40分。每小题只有一个选项符合题意)
1.第一次用无机物制备有机物尿素,开辟人工合成有机物先河的科学家是
A.德国的维勒 B.英国的道尔顿
C.德国的李比希 D.俄罗斯的门捷列夫
2.下列系统命名法正确的是
A.2—甲基—4—乙基戊烷 B.3,4,4—三甲基己烷
C.2,3—二乙基—1—戊烯 D.间二甲苯
3.下列分子式表示的物质,具有同分异构体的是
A.C3H7Cl B.C3H8 C.CH2Cl2 D.CH4O
4.下列叙述正确的是
A.铜可导电,所以铜是电解质
B.MgCl2在水溶液中和熔融状态下均可导电,它是电解质
C.HCl、H2SO4液态时都不导电,都是非电解质
D.能导电的单质一定是金属
5.进行中和滴定时,需用的仪器事先不应该用所盛溶液润洗的是
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
6.下列各离子方程式中,属于水解反应的是
A.HS-+H2O![]() H2S+OH-
B.HCO3-+H2O
H2S+OH-
B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=== CO32-+ H2O
D.NH3+H2O![]() OH-+NH4+
OH-+NH4+
7.已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH-)=1×10-3mol·L-1的碱溶液等体积混和后溶液呈酸性,其原因可能是
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
8.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
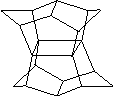 9.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
9.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
A、分子式为C20H20
B、一氯代物的同分异构体只有两种
C、分子中含有二个亚甲基(—CH2—)
D、分子中含有4个五元碳环
10.对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+
6H2O(g),下列叙述正确的是
4NO(g)+
6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
11.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子(H+)。电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是:O2+4H++4e-=2H2O。下列叙述中不正确的是
A.电池的总反应是:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:CH3OH+H2O-6e-=CO2↑+6H+
C.电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入。
D.电池工作时,H+由正极移向负极
12.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g); △H= -192.9 kJ·mol-1
下列说法正确的是
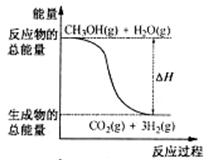 A.CH3OH的燃烧热为192.9
kJ·mol-1
A.CH3OH的燃烧热为192.9
kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:
CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
13.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
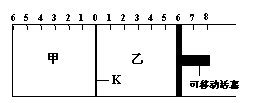 |
A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B.达到平衡后,隔板K最终停留在左侧刻度0~2之间
C.到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
14.已知NaHSO4在水中的电离方程式为:NaHSO4 = Na+
+ H+ + SO![]() 。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
15.一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)
• [c(OH-)]![]() =Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
=Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
① 0.1mol·L![]() AlCl3溶液
② 0.1mol·L
AlCl3溶液
② 0.1mol·L![]() NH4Cl溶液
NH4Cl溶液
③ 0.1mol·L![]() KCl溶液
④ 0.1mol·L
KCl溶液
④ 0.1mol·L![]() KAlO2溶液
KAlO2溶液
A.①④③② B.①②③④ C.③①④② D.④①③②
16.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当
溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
17.下列各条件下可能共存的离子组是
A.某无色溶液中:NH4+、Na+、Cl—、MnO4—
B.由水电离出的c(H+)=1×10—13mol·L—1的溶液中:Na+、K+、SO32—、CO32—
C.在c(H+)=11×10—13mol·L—1的溶液中:NH4+、Al3+、SO42—、NO3—
D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
18.下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
19.已知:N2(g)+3H2(g) ![]() 2NH3(g);△H= —92.4kJ/mol,在相同温度下,向一密闭容器中通入0.6mol N2、1.8mol H2和0.8mol NH3达平衡时反应的热效应(即放出或吸收的热量)为QlkJ;向另一体积相同的密闭容器中通入0.5mol
N2和1.5mol
H2、lmol NH3,达到平衡时反应的热效应为Q2kJ,则下列判断一定错误的是
2NH3(g);△H= —92.4kJ/mol,在相同温度下,向一密闭容器中通入0.6mol N2、1.8mol H2和0.8mol NH3达平衡时反应的热效应(即放出或吸收的热量)为QlkJ;向另一体积相同的密闭容器中通入0.5mol
N2和1.5mol
H2、lmol NH3,达到平衡时反应的热效应为Q2kJ,则下列判断一定错误的是
A.Q2<Ql<92.4 B.Q1=Q2=92.4 C.Q1<Q2<92.4 D.Q1=Q2<92.4
20.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在,Cl—可能存在 B.100mL溶液中含0.01mol CO32—
C.K+可能存在,Cl—一定存在 D.Ba2+一定不存在,Mg2+可能存在
 高二化学试题
高二化学试题
第Ⅱ卷 非选择题(共60分)
21.(8分)质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的化学式为_____________。
已知该物质可能存在多种结构,A.B.C是其中的三种,请根据下列要求填空:
(2)A与氢气加成生成2—甲基戊烷,则A的可能结构有___________种。
(3)B能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则B的结构简式为:
________________________。
(4)C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:
____________________________ 。
22.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。
结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:____________
假设二:__________________________________________
23.(14分) A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是由两种元素组成的化合物,D是一种红棕色固体,H的焰色反应呈黄色。
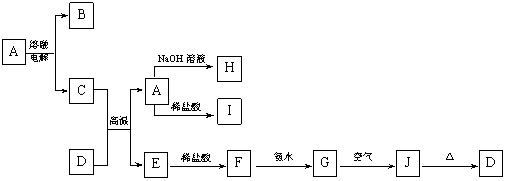 |
请回答下列问题:
(1)B物质的化学式为_________,H物质的名称为________________。
(2)G→J的化学方程式为________________________ ___________。
(3)D物质与盐酸反应所得溶液显酸性的原因是(用离子方程式表示):
_____________ 。
(4)E与碳形成的合金在潮湿的空气中易发生电化学腐蚀,其正极的电极反应式为:
______________ _ ____。
(5)写出一个满足下列两个条件的置换反应方程式:
①在A——J中选一种单质作为反应物;②生成物之一是具有磁性的氧化物。
_______________ ____ ____。
24.(16分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
![]() H2B=H++HB- HB- H++B2-
H2B=H++HB- HB- H++B2-
回答下列问题:
(1)Na2B溶液显 (填“酸性”“中性”或“碱性”),理由是
(用离子方程式表示)。
(2)在0.1mol/L的Na2B的溶液中,下列粒子浓度关系正确的是( )
A.C(B2-)+C(HB-)+C(H2B)=0.1mol/L
B.C(Na+)+C(OH-)=C(H+)+C(HB-)
C.C(Na+)+C(H+)=C(OH-)+C(HB-)+2C(B2-)
D.C(Na+)=2C(B2-)+2C(HB-)
(3)已知0.1mol/LNaHB溶液是PH=2,则0.1mol/LH2B溶液中氢离子的物质的量浓度可能是 0.11mol/L(填“<”“>”或“=”),理由是
。
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是
。
25.(12分)
化学工业在国民经济中占有极其重要的地位,硫酸是一种极为重要的化工产品。
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填序号)
A.矿石加入沸腾炉之前先粉碎
B.V2O5作催化剂
C.接触室中不使用很高的温度
D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行
F.吸收塔中用98.3℅的浓硫酸吸收SO3
(2)若实验室在573℃,1.01×105Pa和催化剂存在条件下,向某密闭容器中充入
1molSO2和0.5molO2,此时体积为100L。在此温度和压强不变条件下反应达
到平衡,SO3体积分数为0.91。若保持温度和压强不变,充入1molSO3,则
平衡时SO2体积分数为 。若保持温度和体积不
变,充入a molSO2和b molO2,且a:b=2:1,反应达到平衡时SO3体积分数
仍然为0.91,则a= 。