高二化学第一学期期末试卷
试卷总分:120分 考试时间:100分钟
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Al-27
第I卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)
![]() 1、2008年北京奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构简式如右图)。下列说法不正确的是
( )
1、2008年北京奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维(结构简式如右图)。下列说法不正确的是
( )




A.羊毛与聚酯纤维的化学成分不相同 B.聚酯纤维和羊毛一定条件下均能水解
C.该聚酯纤维单体为对苯二甲酸和乙二醇 D.由单体合成聚酯纤维的反应属于加聚反应
2、有关化学用语正确的是 ( )
A.乙炔的最简式C2H2 B .乙醛的结构简式 CH3COH
C .水的电子式![]() D. 硬脂酸甘油脂
D. 硬脂酸甘油脂
3、设C+CO2![]() 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2![]() 2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为
( )
2NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为
( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
4、2005年10月12日我国成功发射了“神州六号”。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g) 2NO2(g);△H =+67.7kJ/mol
N2H4(g)+O2(g) N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
 A.2N2H4(g)+2NO2(g)
A.2N2H4(g)+2NO2(g) 3N2(g)+4H2O(l);△H=-1135.7kJ/mol
B.2N2H4(g)+2NO2(g) 3N2(g)+4H2O(g);△H=-1000.3kJ/mol
C.N2H4(g)+NO2(g) 3/2N2(g)+2H2O(l);△H=-1135.7kJ/mol
D.2N2H4(g)+2NO2(g) 3N2(g)+4H2O(g);△H=-1135.7kJ/mol
5、据2006年11月12 中央电视台每周质量报告报道,北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物。

![]()
红心鸭蛋 苏丹红Ⅳ号
下列关于“苏丹红Ⅳ号”说法正确的是 ( )
A.属于芳香烃 B.能与NaOH溶液反应
C.不能使酸性KMnO4溶液褪色 D.不能发生加成反应
6、由2一氯丙烷制取少量1,2一丙二醇时,需要经过下列哪几步反应 ( )
A.消去→加成→水解 B.加成→消去→取代
C.消去→加成→消去 D.取代→消去→加成
7、下列说法中正确的是 ( )
A.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率是
前者大于后者
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等
C.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量前者小于后者.
D.100 mL 0.1 mol·L-1的硫酸和盐酸溶液,与足量锌反应后,两者放出氢气的速率相等但质量不相等
8、下列说法或表示方法中,正确的是 ( )
A.由热化学方程式:1/2C2H5OH(l)+3/2O2(g) CO2(g)+3/2H2O(l)
△H=-683.4kJ/mol知乙醇的燃烧热为683.4kJ/mol
B.由C(金刚石)→ C(石墨):△H= —119 kJ/mol可知,金刚石比石墨稳定
C.H+(aq) + OH一(aq) = H2O(1);△H=—57.3KJ/mol。
若将含0.5mol H2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.在101kPa 25℃时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,
则氢气燃烧的热化学方程式表示为:2H2(g) + O2(g) == 2H2O(1);△H = —285.8 kJ/mol
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。)
9、能正确表示下列反应的离子方程式是 ( )
A.苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
B.硫化钠的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO![]()
BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-
CaCO3↓+H2O
10、常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中![]() =1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
( )
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
( )
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
11、在一密闭容器中,反应m A(g)+n B(g) ![]() 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )
A.A的质量分数减小 B.平衡向右移动
C.化学计量数:m+n > 3 D.物质C的体积分数减小
12、下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通![]() 后,使c、d两点短路.下列叙述正确的是
( )
后,使c、d两点短路.下列叙述正确的是
( )
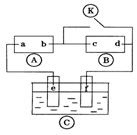 A.a为直流电源的负极
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生氧化反应
13、如下表,为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是 ( )
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 福尔马林(甲酸) | Na2CO3溶液 | 蒸馏 |
| D | 苯(苯酚) | 溴 水 | 分液 |
14、某有机物A是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是 ( )
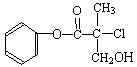 A.有机物A属于芳香烃
A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1mol A和足量的NaOH溶液反应,可以消耗3mol NaOH
第II卷(非选择题,共72分)
三、填空题(15-22题,共72分)
| 金属离子 | PH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Zn2+ | 7.6 | 8.3 |
| Cu2+ | 5.8 | 7.5 |
| Al3+ | 4.0 | 5.4 |
| Fe3+ | 2.7 | 3.7 |
15、(8分)工业上采用湿法炼锌过程中, 以ZnSO4为主要成分的浸出液中,有Fe3+、Fe2+、Al3+、Cu2+、Cd2+、Cl-等杂质,这些杂质对下一道锌的电解工序有妨碍,必须事先除去。要将溶液中的Fe2+、Cu2+、Al3+、Fe3+沉淀为氢氧化物,需溶液的pH分别为9.6、7.5、5.4 、3.7。数据如右图
现有下列试剂:① KMnO4;②NaOH;③ZnO;④H2O2;⑤Zn;⑥Fe;⑦AgNO3;⑧Ag2SO4;⑨H2SO4
根据要求将合适的试剂的序号填入下面的空格:
(1) 用 将Fe2+离子氧化成Fe3+离子,
相应的离子方程式为 。
(2) 用 调节浸出液的pH = 5.5时, 、 等形成氢氧化物沉淀而除去。
(3) 用 除去Cu2+和Cd2+离子。 用 除去Cl-离子。
16、(12分)在25mL 0.1mol·L-1 盐酸溶液中滴入0.2mol·L-1 NaOH溶液,以酚酞为指示剂。(1)填写下表中所有空格:(计算结果保留一位小数)
| ①加入NaOH溶液的体积(mL) | 5.0 | 7.5 | 10.7 | 12.0 | 12.3 | a | 12.8 | 13.0 | b | 17.5 | 20.0 |
| ②溶液pH | 1.3 | 1.5 | 2.0 | 2.6 | 3.0 | 7.0 | 11.2 | 11.4 | 12.0 | 12.4 | 12.5 |
| ③指示剂的颜色 | 无 | 无 | 无 | 无 | 无 | 粉红 | 红 | 红 | 红 | 红 | 红 |
a mL 、 b mL
(2)根据上表中的数据,在下图格纸中,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意图。(坐标中pH变化及体积变化要标明)
|
0 5 10 15 20
(3)在实验中,必不可少的玻璃仪器是___________________________ _____。
(4)进行中和滴定操作时,眼睛注视__ _
滴定终点的判断依据是______________________ _____________。
(5)在操作中,锥形瓶用蒸馏水洗净后,未经干燥即进行滴定造成测定结果 填(“偏高”、“偏低”、“无影响”)
17、(8分)已知:①R—![]() —
—![]()
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响,
以下是用苯作原料制备一系列化合物的转化关系图:

(1)图中“苯→①→②”省略了反应条件,请按要求写出下列化学方程式
苯→A
A→B______________________________________________。
(2)请写出①、②物质的结构简式:
①________________________,②____________________________。
18、(8分)已知反应:(1)![]()
(2)![]()
现有物质A~I的转化关系如下图:
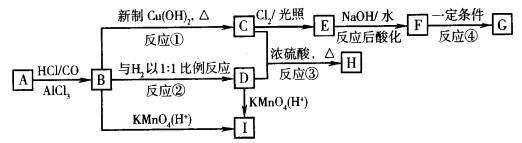
若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。
请回答下列问题:
(1)写出有关物质的结构简式:F
,I 。
(2)写出下列反应的化学方程式:
B→C
;
C + D→H
。
(3)C的同分异构体且属于酯类的芳香族化合物共有6种,以下已有四种,请写出另两种同分异构体的结构简式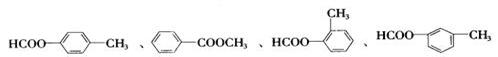
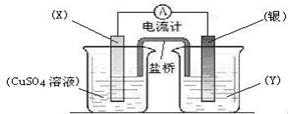 19、(6分)、依据氧化还原反应:2Ag+(aq) +
Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
19、(6分)、依据氧化还原反应:2Ag+(aq) +
Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是 ; 电解质溶液Y是 ;
(2)银电极为电池的 极, 发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
20、(14分)
(1)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个极通入空气,另一个极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
这个电池负极发生的反应是: C4H10+13O2--26e- =4CO2+5H2O,
正极发生的反应是: ;
汽油燃料电池最大的障碍是氧化反应不完全产生 (填化学式)堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
(2)某温度下0.1mol/L Na2CO3溶液中,C(Na+)/C(CO32—)==20/9>2,
其原因是(用离子方程式说明):- ,
![]() 常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5 的Al2(SO4)3
常温下,pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=5 的Al2(SO4)3
溶液中由水电离出的H+ 浓度为c2,则 = ;
![]() (3)恒温、恒压下,在一个可变容积的容器中发生如下反应: A(g) +
B (g) C (g)
。
(3)恒温、恒压下,在一个可变容积的容器中发生如下反应: A(g) +
B (g) C (g)
。
①若开始时放入1 mol A 和 1 mol B ,到达平衡后,生成 a mol C ,这时 A 的物质的量为__________mol。
②若开始时放入 X mol A 、2mol B 和 1 mol C ,到达平衡后,A 和 C 的物质的量分别是 Y mol 和 3a mol ,则 X=__________,Y=______________
21(8分)、碳、氢、氧3种元素组成的有机物A,相对分子质量为氢气的51倍,含氢的质量分数为9.8%,分子氢原子个数为氧的5倍。A有2个不同的含氧官能团,一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
(1)A的分子式是 。B的结构简式
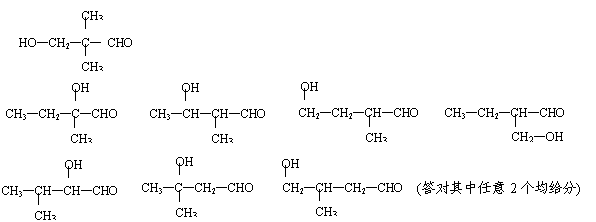
(2)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:
、 。
(3)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是
。
22、(8分)有机物A由碳、氢、氧三种元素组成。现取3 g A与 4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物均没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。
⑴ 有机物A中C、H、O三种原子的物质的量之比。
⑵ 回答由此能否确定该有机物的分子式。为什么?
(3)在运用PMR谱确定该有机物结构时,在核磁共振谱上给出的峰有三个信号峰,其强度之比为6 :1 :1,该组信号峰对应物质的结构简式为 ,

高 二 化 学
试卷总分:120分 考试时间:100分钟
第I卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意)
1、D 2、C 3、A 4、D 5、B 6、A 7、C 8、C
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分。)
9、A 10、C 11 、CD 12、BD 13、C 14、D
非选择题,共72分)
三、填空题(15-22题,共72分)
15、(8分)
(1) ④ 、(1分)2Fe2++ H2O2 + 2H+ = 2Fe3+ + 2H2O(2分)。
(2) ③ Fe3+ Al3+ (各1分)
(3) ⑤ ⑧ (各1分)。
16、(12分) (1) 12.5 、 b 14.5(14.47) (各1分)。
(2)
|
0 5 10 15 20
(3)酸式滴定管 碱式滴定管 锥形瓶(3分)
(4)锥形瓶中溶液颜色的变化(1分),溶液由无色变为粉红色(或浅红) (1分)
,且半分钟内不变色. (1分)
(5)“无影响” (2分)
17、(8分)![]() +
HO—NO2
→
+
HO—NO2
→![]() —NO2 + H2O
—NO2 + H2O
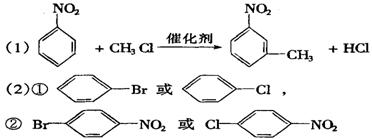
(各2分)
18、(1)HOOC![]() CH2OH、HOOC
CH2OH、HOOC![]() COOH (各2分)
COOH (各2分)
![]() (2分)
(2分)
(2)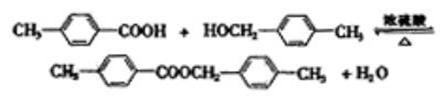 (2分)
(2分)
(3)![]() CH2OOCH
(2分)
CH2OOCH
(2分)
![]() OOCCH3(2分)
OOCCH3(2分)
19、(6分(1)Cu AgNO3 (各1分)(2)正极 Ag+ +e-=Ag↓ Cu-2e-=Cu2+(各1分)(3)X Ag(1分)
20.(14分)
(1)O2+4e-=2O2-,(2分), C (碳粒) (2分)
![]() (2)
CO32—+ H2O HCO3 — + OH— (2分) 10-4 (2分)
(2)
CO32—+ H2O HCO3 — + OH— (2分) 10-4 (2分)
(3)1-a (2分), 2 (2分) , 3 -3a(2分)
 21、 (1)C5H10O2 (2分)
21、 (1)C5H10O2 (2分)
(2)
|
|
22、(1)n(H)=2n(H2O)=0.4mol(1分)
n(C)=n(CO2)+n(CO)
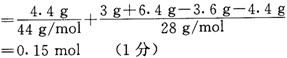
3 g A中,n(H)=0.4mol, n(C)=0.15mol,
n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)=2×0.1 mol+0.05 mol+0.2 mol-2×0.2 mol
=0.05mol (1分)
所以,n(C)︰n(H)︰n(O)=3︰8︰1
(2)可以确定,因为氢原子已使碳达饱和。
A的分子式为C3H8O (2分) (3)CH3CH(OH)CH3 (2分)
说明:(1)化学非选择题其他合理答案可参照评分标准给分。
(2)化学方程式和离子方程式每题2分,正确写出反应物和生成物得1分;未配平或反应条件有误扣1分;但只要反应物或生成物有误则扣2分。