高二化学第一学期期末质量调研试题
高二化学试题
命题人:刘振伟 审稿人:董小川 蒋亦平 韩新由 吴永才
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分120分,考试时间100分钟。
可能用到的相对原子质量:H 1 O 16 C 12 Na 23
| 题号 | 一 | 二 | 三 | 四 | 五 | 合计 |
| 得分 |
第Ⅰ卷 选择题(共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只是一个选项符合题意)
1.2008年北京奥运会“祥云”火炬用的是环保型燃料—丙烷,悉尼奥运会火炬所用燃料为65%的丁烷和35%的丙烷。含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 | 36.1 |
| 燃烧热(kJ·mol-1) | 1560.7 | 2219.2 | 2877.6 | 3535.6 |
根据表中数据,下列判断中错误的是
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.正庚烷在常温常压下肯定不是气体
C.烷烃燃烧热和其所含碳原子数成线性关系
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
2.2005年3月2日世界卫生组织(WHO)和世界粮农组织(FAO)联合发生警告,油煎和烘烤的食品中含有浓度严重超标的丙烯酰胺(CH2==CHCONH2),它是一种二级致癌物质。下列有关丙烯酰胺的叙述中错误的是
A.丙烯酰胺能使溴水褪色
B.丙烯酰胺分子内所有原子不可能在同一平面内
C.丙烯酰胺属于一种氨基酸
D.丙烯酰胺在一定条件能发生加聚反应生成高分子化合物
3.由2-溴丙烷为主要原料制取1,2-丙二醇时需要经历的反应依次是
A.消去→加成→取代 B.加成→消去→取代
C.取代→消去→加成 D.取代→加成→消去
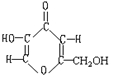 4.曲酸是一种非常有潜力的食品添加剂。经测定曲酸的分子式为C6H6O4,结构式如右图所示,试根据曲酸分子结构特点,推测曲酸不可能具有的性质为
4.曲酸是一种非常有潜力的食品添加剂。经测定曲酸的分子式为C6H6O4,结构式如右图所示,试根据曲酸分子结构特点,推测曲酸不可能具有的性质为
A.能发生酯化反应 B.易溶于水、醇
C.具有抗氧化性 D.具有强酸性
5.下列各组物质中只用水就能鉴别的一组是
A.乙醛、乙二酸、硝基苯 B.乙醇、乙醛、乙酸
C.苯、乙酸、四氯化碳 D.苯酚、乙醇、甘油
6.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g) +Cl2(g) =2HCl(g); △H=-184.6kJ/mol
B.CO(g) +1/2O2(g) =CO2(g); △H=-283kJ/mol
C.CH4(g) +2O2(g) =CO2(g) +2H2O(g); △H=-802.3kJ/mol
D.2H2(g) +O2(g) =2H2O(l); △H=-571.6kJ/mol
7.某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
| 时间 | 1 min | 2 min | 5 min | 15 min | 20 min |
| 现象 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
反应1~15min内,铝与盐酸的反应速率变化的可能原因是
A.该反应是放热反应,温度升高 B.反应过程中盐酸的浓度增大
C.随着反应的进行,铝片表面积变小 D.Cl-离子是该反应的催化剂
8.反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2==2HCl的反应速度V可表示为V=K![]() 式中K为常数,m、n值可用下表中数据确定之。
式中K为常数,m、n值可用下表中数据确定之。
|
|
| V(mol/L·s) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
由此可推得,m、n值正确的是
A.m=1、n=1 B.m=![]() 、n=
、n=![]() C.m=
C.m=![]() 、n=1 D.m=1、n=
、n=1 D.m=1、n=![]()
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.最近研究证明,钒对糖尿病的治疗有特殊的疗效,患者饮用含少量偏钒酸钠和食盐的混合溶液,4天后血液中的糖量即可恢复正常。但钒的化合物有毒,人吸收多了会得肺水肿。下列叙述正确的是
A.人体血液中含的糖是蔗糖,医院注射所用的糖也是蔗糖
B.检测糖尿病患者尿液的实质就是检测含不含蔗糖
 C.钒在元素周期表中处于第四周期
C.钒在元素周期表中处于第四周期
D.V2O5常用作制硫酸和有机合成的催化剂
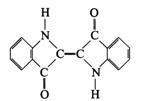
10.历史上最早应用的还原性染料是靛蓝,其结构简式如图所示
下列关于靛蓝的叙述中错误的是
A.靛蓝有碳、氢、氧、氮四种元素组成 B.它的分子式是C16H14N2O2
C.靛蓝是高分子化合物 D.它是不饱和的有机物
11.工业上将苯的蒸气通过赤热的铁合成一种可作热载体的化合物,该化合物分子中苯环上的一氯代物有3种,1mol该化合物催化加氢时最多消耗6mol氢气,判断这种化合物可能是
A. ![]() B.
B.![]()
C.![]() D.
D.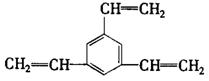
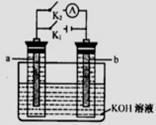 12.如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
12.如右图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K2,闭合K1时,a极上的电极反应式为:4OH-―4e-=== O2↑十2H2O
C.断开K1,闭合K2时,b极上的电极反应式为: 2H++2e-=== H2↑
D.断开K1,闭合K2时,OH-向b极移动
13.某有机物蒸气amol完全燃烧时,恰好需要3amol的O2,产生2amol的CO2,该有机物可能是
A.C2H4 B.CH3CHO C.C2H5OH D. CH3COOH
14.工业上制取Ti通常先由金红石(TiO2)制取TiCl4:
己知:①C (s) +O2 (g) =CO2 (g); △H = -393.5 kJ·mol-1
②CO (g) + ![]() O2 (g) =CO2 (g);
△H = -283 kJ·mol-1
O2 (g) =CO2 (g);
△H = -283 kJ·mol-1
③TiO2(s) + 2Cl2 (g) =TiCl4(s) + O2(g); △H = +141 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s) + 2CO (g)的△H为
A.+80 kJ·mol-1 B.-80 kJ·mol-1 C.+50 kJ·mol-1 D.-50 kJ·mol-1
请将选择题答案填在下列表格中:
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二、选择题
| 9 | 10 | 11 | 12 | 13 | 14 |
第Ⅱ卷 非选择题(共72分)
![]() 三、(本题包括2小题,共24分)
三、(本题包括2小题,共24分)
15.甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1H2SO4溶液中,乙同学将电极放入6 mol·L-1 NaOH溶液中,如下图所示:
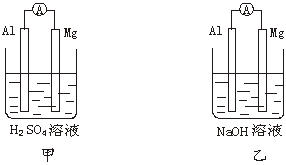
回答下列问题:
(1)写出甲池中正极的电极反应式:
正极:_______________________________________________________。
(2)写出乙池中负极的电极反应式:
负极:_______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___________活动性更强,而乙会判断出_________活动性更强(填写元素符号)。
(4)由此实验,可得出如下哪些正确结论?______________。(填序号)
A.利用原电池判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
16.乙醇的分子式是C2H6O,由于有机化合物普遍存在同分异构现象,推测乙醇结构可能是下列两种之一:

(A) (B)
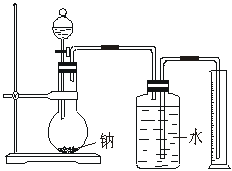
现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四名学生利用如上图所给的实验装置进行有关的实验来确定乙醇的结构。回答下列问题:
(1)学生甲得到一组实验数据:
| 乙醇的物质的量 | 氢气的体积(标准状况) |
| 0.10 mol | 1.12 L |
根据以上数据推断乙醇的结构应为_______________________,(选填A或B)
理由是_____________________________________________________________ 。
(2)学生乙分别准确称量4.60g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况后都小于1.12L。如果忽略量筒本身读数造成的误差,那么学生乙认为是由于样品乙醇中含有少量水造成的,你认为正确吗?
答:________________。(填“正确”或“不正确”)。如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?
________________________________ 。
(3)学生丙认为实验成功的关键有:A.装置气密性良好;B.实验开始前准确确定乙醇的量;C.钠足量;D.广口瓶内必须充满水;E.氢气体积的测算方法正确、数值准确。
你认为其中正确的有_____________________________________(填序号)。
(4)学生丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是___________________________________________。
(5)实验后四名学生从乙醇的可能结构分析入手对乙醇和钠的量的关系进行讨论,如果乙醇的物质的量为nmol,那么对钠的质量取值要求必须是___________________________。
![]() 四、(本题包括3小题,共36分)
四、(本题包括3小题,共36分)
17.科学家预测“氢能”将是未来最理想的新能源。
⑴实验测得,1克氢气燃烧生成液态水放出142.9 kJ热量,写出氢气燃烧的热化学反应方程式: 。
![]()
![]() ⑵根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
⑵根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
![]()
![]() ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
你认为该方法的主要缺点有:
。
⑶利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫—碘热循环法),其中用了过量的碘。
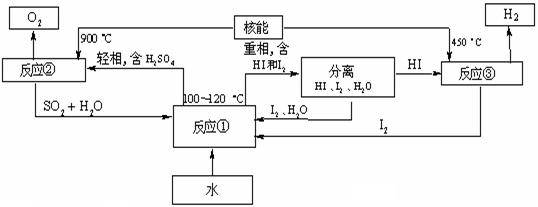
写出反应①的离子反应方程式: 。
写出反应③的化学反应方程式: 。
⑷有人认为利用氢气作为能源比较现实,请说明能够支持这种观点的两点理由:
。
也有人认为利用氢气作为能源不太现实。请说明能够支持这种观点的两点理由:
。
![]()
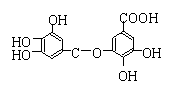 18.四川省盛产一种叫五倍子的药材。以五倍子
18.四川省盛产一种叫五倍子的药材。以五倍子
为原料可制得化合物A。A的结构简式如右图所示:
请解答下列各题:
(1)A含有的官能团是 。(写名称)
(2)A的分子式是 。
(3)有机化合物B在硫酸催化条件下加热发生取代反应可得到A,
则B的结构简式为: 。
(4)下列关于有机化合物B的叙述中不正确的是 。(填序号)
A.属于烃的衍生物
B.1mol B可与4mol NaHCO3恰好完全反应
C.有机物B可发生取代反应,也可发生加成反应
D.有机物B不易被氧化
(5)请写出A与过量氢氧化钠溶液反应的化学方程式:
。
19.以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
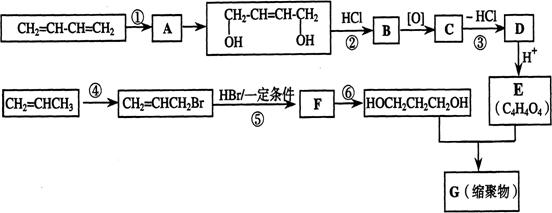
请完成下列各题:
(1)写出反应类型:反应① 反应④ 。
(2)写出反应条件:反应③ 反应⑥ 。
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是:
。(写出一种物质的结构简式)
(6)写出G的结构简式 。
![]() 六、(本题包括1小题,共12分)
六、(本题包括1小题,共12分)
20.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)= v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,各物质平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)830℃时,在该密闭容器中充入CO和H2O各1mol。达到平衡时CO的转化率α为 。
(6)830℃时,若在该密闭容器中充入CO 1mol和H2O n mol(n>1)。求达到平衡时CO转化率α的范围 。