高二化学第二学期第一次月测题
2008.3.25
满分150分 时间120分钟
第一部分选择题(共 63 分)
一、选择题(每小题只有一个正确答案,每小题3分,9小题共27分)
1.一定量的锎(98252Cf)是有用的中子源,1mg(98252Cf)每秒约放出2.34xl99个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是 ( )
A、(98252Cf)原子中,中子数为154 B、(98252Cf)原子中,质子数为98
C、(98252Cf)原子中,电子数为 98 D、锎元素的相对原子质量为252
2. NA表示阿伏加德罗常数,下列说法中正确的是( )
A.3.6 g重水中所含质子数为2NA
B.1 mol S与足量Cu反应生成Cu2S转移NA个电子
C.1molCH4分子中共价键总数为4NA
D.4.48 L N2所含分子数为0.2 NA
3.已知“凡气体分子总数增多的反应一定是熵增大的反应”。一定条件下,下列反应不可能自发进行的是 ( )
A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
4.下列关于化学用语“NH4Cl”的意义,不正确的是: ( )
A.氯化铵分子中含有一个NH4+和一个Cl—
B.氯化铵由N、H、Cl三种元素组成
C.氯化铵晶体由NH4+和Cl-构成
D.氯化铵晶体中阴、阳离子个数比为1:1
5.下列说法正确的是( )
A.乙烯的结构简式可以表示为CH2CH2 B.苯、乙醇和乙酸都能发生取代反应
C.油脂都不能使溴的四氯化碳溶液褪色 D.液化石油气和天然气的主要成分都是甲烷
6. 以下各种尾气吸收装置中,不适合于吸收HCl气体,且不能防止倒吸的是( )
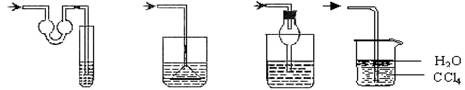
A B C D
7.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是()
A、用蒸馏水冼净滴定管后,装入标准盐酸进行滴定;
B、用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH液
C、用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D、改用移液管取10.00mLNaOH溶液,放入锥形瓶后,把移液管尖嘴处液体吹入。
8.在雷达的微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是( )
A .可表示为3YO3·3FeO·Fe2O3 B.可表示为Y3O5·Fe3O4·Fe2O3
C. 其中钇、铁的化合价均为+3价 D.其中钇、铁的化合价均有+2、+3价
9.已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是 ( )
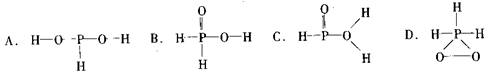
二、选择题(每小题有l~2个正确答案,每小题4分, 9小题题共36分)
10、在指定环境中,下列各组离子可以大量共存的是 ( )
A、在中性溶液中:Al3+、K+、S042—、 HCO3—
B、在0.1mol/L的氯化铁溶液中:Fe3+、NH4+、NO3—、Cl—
C、在PH =11的溶液中:S2一、S032—、K+、Na+、C032—
D、在酸性溶液中: AlO2—、K+、I一、NO3—、Na+
11. 一定条件下,碘单质与砹单质以等物质的量进行反应可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。
则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物 B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂 D.AtI与液氨反应,是自身氧化还原反应
12.下列离子方程式书写正确的是( )
A.三氯化铝溶液中加人过量氨水 Al3++3OH- =Al(OH)3↓
B. 稀硝酸中加入过量的铁粉:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
C. 4mol/L的NaAlO2溶液和7mol/L的HCI等体积互相均匀混合
4AlO2-+7H++H2O = 3Al(OH)3↓+Al3+
D. 盐酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
13. 在一定条件下,将3mol
A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol
D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8mol
D,并测得C的浓度为0.2mol·L-1。下列判断错误的是( )
A. x=1 B. 2min内A的反应速率为0.3 mol·(L·min)-1
C. B的转化率为40% D. 若混合气体的密度不变则表明该反应达到平衡状态
14. 常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
A. pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
B. pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
C. pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D. pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
15. 相同温度下,中和10ml pH=10的氨水,须pH=2的盐酸a ml,若中和10ml pH=11的氨水,须pH=1的盐酸b ml,则a和b的关系。( )
A.a>b B.a<b C.a=b D.无法确定
16.关于晶体的下列说法正确的是 ( )
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体高
D.分子晶体的熔点一定比金属晶体的低
17.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期. Tl3+与Ag在酸性介质中发生反应: Tl3++2Ag== Tl++2Ag+.下列推断正确的是 ( )
A.Tl+最外层有一个电子 B.Tl3+比Al3+氧化性强
C.Tl能形成+1和+3价的化合物 D.Tl+还原性比Ag强
18.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,下列对该燃料电池说法正确的是 ( )
A.在熔融电解质中O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2 === 8CO2 +10H2O
C.通入空气的一极是正极,电极反应:O2+4e- ==== 2O2-
D.通入丁烷的一极是正极,电极反应为: C4H10+13O2-+26e- === 4CO2 +5H2O
第二部分非选择题(共 87 分)
三、(本题包括3小题,共30分)
19.(9分)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在尺寸的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将 (填高于或低于)右边的托盘。欲使天平平衡,所进行的操作应为
![]() 假设最终称得小烧杯的质量为
(填32.6g或32.61g),请用“↓”表示在托盘上加砝码,用“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码位置(画 表示)
假设最终称得小烧杯的质量为
(填32.6g或32.61g),请用“↓”表示在托盘上加砝码,用“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码位置(画 表示)
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 |
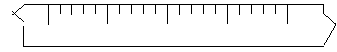
标尺
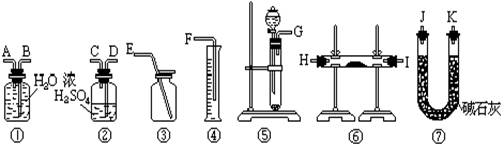 |
20.(8分)现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6摩尔/升盐酸和蒸馏水).请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式.
(2)应选用的装置是(只要求写出图中装置的标号)
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略).
|
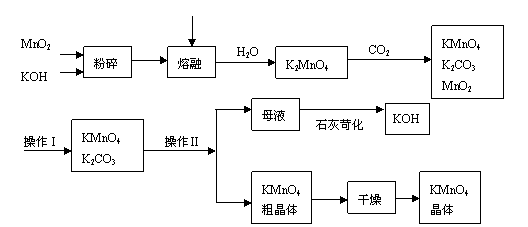

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。 a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
所需气体发生装置是_____________(选填代号)。
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
四、(本题包括3小题,共28分)
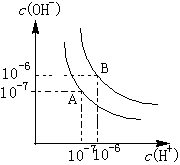 22.(8分)水的电离平衡如右图所示。
22.(8分)水的电离平衡如右图所示。
(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
(3)已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下
Ca(OH)2的溶解度为0.74g,其饱和溶液的密度为1g/mL,其离子积为 。
23.(8分)将0.2mol·L-1 HA溶液与0.2mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白)。
(1)混合溶液中c(HA)_______c(A-);
(2)混合溶液中c(HA)+c(A-)______0.1mol·L-1;
(3)混合溶液中,由水电离出的c(OH-)______0.2mol·L-1HA溶液由水电离出的c(H+);
(4)25℃时,如果取0.2mol·L-1 HA溶液与0.11 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
24.(12分)根据图示填空
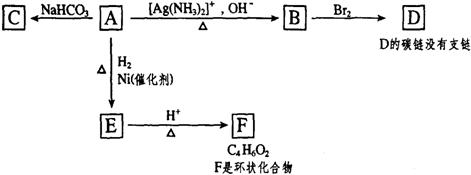
(1)化合物A含有的官能团是 。
(2)1mol A与2mol H2反应生成1molE,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。由E生成F的反应类型是 。
五、(本题包括2小题,25分)
![]() 25.(11分)有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
25.(11分)有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
(1)若将4molA和2molB在2L的容器中混合,经2s后测得C的浓度为0.6mol·L-1,用物质A表示的平均反应速率为____________;2s时物质B的浓度为_______________;
(2)若把amolA和bmolB充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4molA和2molB加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A
的体积分数再达到与原平衡状态相同,可采取的措施有
26.(14分)(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:
H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+ =2Fe3++ 2H2O 。
在以上反应中Fe3+实际上起着 作用,总反应式为 。
(2) I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
H2O2+I2=2HIO, 。
总反应式为 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为: 。
(4)铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
(5)铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:
Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O
配平化学方程式,并标出电子转移的方向和数目。
Fe2O3 + NaNO3 + NaOH — Na2FeO4 + NaNO2 + H2O
高二化学第一次月测题
高二( )班 姓名 考号
一、二选择题(1~9每题3分,10~18每题4分,共63分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、(本题包括3小题,共30分)
19.(9分)将 (填高于或低于)所进行的操作应为
质量为 (填32.6g或32.61g)
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 |

标尺
20.(8分)
(1)化学方程式.
(2)是 (3)连接顺序应是
21.(13分)
(1)是 (2)是
(3)有 、 (写化学式)。
(4)__________mol KMnO4。
(5)最好选择___________(选填代号)。所需气体发生装置是_____________ (选填代号)
(6)名称是_____________; __________ 采用 (操作步骤)
四、(本题包括3小题,共28分)
22.(8分)
(1)水的离子积为 (2)体积比为 (3)其离子积为
23.(8分)
(1) ;(2) ;(3) ;(4)
24.(12分)
(1) 。
(2)其反应方程式是
(3) (4)
(5) 反应类型是
五、(本题包括2小题,25分)
25. (11分)
(1) ; ;(2)
(3)__________; ___________可采取的措施有
26.(14分)(1) 作用,总反应式为
(2)
H2O2+I2=2HIO,
总反应式为
(3)离子方程式为:
(4)另一原因是
(5) 配平化学方程式,并标出电子转移的方向和数目。
Fe2O3 + NaNO3 + NaOH — Na2FeO4 + NaNO2 + H2O
高二化学第一次月测题
高二( )班 姓名 考号
一、二选择题(1~9每题3分,10~18每题4分 共63分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| D | C | B | A | B | B | C | C | B |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| BC | B | CD | D | BC | B | A | C | BC |
三、(本题包括3小题,共30分)
19.(9分)将 高于 (1分)(填高于或低于)所进行的操作应为 应将左边的调节螺丝向外旋(2分) 质量为 32.6 (1分) (填32.6g或32.61g)
顺序不对不给分(3分)
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
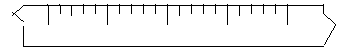
标尺(2分)
20.(8分)
答案1.(1)化学方程式.
2Na2O2+2H2O=4NaOH+O2↑ (2分) Na2O+H2O=2NaOH (2分)
(2)是 ⑤①④ (2分)(3)连接顺序应是 (G)接(A)(B)接(F) (2分)
21.(13分)
(1)是 ab(2分)(2)是 d(1分)
(3)循环使用的物质有 MnO2 ; KOH (2分)(写化学式)。
(4) ![]() mol (2分)KMnO4。
mol (2分)KMnO4。
(5)cd(2分)发生装置是A(1分)
(6)名称是过滤(1分); 溶解度(1分) 采用浓缩结晶(只填“结晶”不给分)(1分);
四、(本题包括3小题,共28分)
22.(8分)
(1)水的离子积为 10-12 (2分)(2)体积比为 2:9(3分)(3)其离子积为 0.004(3分)
23.(8分)
(1) < (2分);(2) = (2分);(3)>(2分);(4) > (2分)
24.(12分)
(1)碳碳双键,醛基、羧基(3分。对一个给1分,错一个扣1分。或写结构简式)
(2)其反应方程式是 OHC-CH=CH-COOH+2H2![]() HO-CH2-CH2-CH2-COOH (2分)
HO-CH2-CH2-CH2-COOH (2分)
(3)
![]() (2分)
(4)
(2分)
(4)
![]() (2分)
(2分)
(5) ![]() 或
或![]() (2分)反应类型是 酯化反应 (1分)
(2分)反应类型是 酯化反应 (1分)
五、(本题包括2小题,25分)
25.(11分)(1)0.3mol·L-1·S-1;0.7mol·L-1(各2分)(2)![]() ×100% (2分)
×100% (2分)
(3)85.7%(2分);减小 (1分) 可采取的措施有 升高温度 充入A气体 减小压强 (2分)
26.(14分)(1)催化剂(或催化)(1分)作用,总反应式为 2H2O2===== O2↑+ 2H2O(2分)
(2)
|
总反应式为 2H2O2 ===== O2↑+ 2H2O (2分)
(3)离子方程式为: 3H2O2 +2H+ +2I- = I2 + 4H2O +O2↑ (2分)
(4)另一原因是 生成的Fe3+离子水解可产生Fe(OH)3胶体,吸附水中悬浮的的杂质。 (2分)
(5) 配平化学方程式,并标出电子转移的方向和数目。
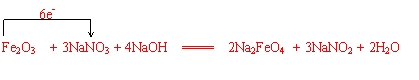 |
(3分)
(配平2分,转移方向和数目1分,共 3分。用双线桥也可以 )