高二化学秋学期12月月考试题
化 学 试 卷
命题人:徐颖娟
本次考试满分120分,考试时间为100分钟。
可能用到的相对原子质量:H 1 C 12 O 16
一、单项选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1 .诗句“春蚕到死丝方尽,……”,诗中的“丝”指的是 ( )
A、纤维素 B、蛋白质 C、淀粉 D、糖类
2.下列塑料的合成,所发生的化学反应类型与另外三种不同的是
A.聚乙烯塑料 B.聚氯乙烯塑料 C.酚醛塑料 D.聚苯乙烯塑料
3.下列四种烃的名称所表示的物质,命名正确的是 ( )
A 2-甲基-2-丁炔 B 2-乙基丙烷
C 3-甲基-2-丁烯 D 2-甲基-2-丁烯
4. 下列各组物质中一定属于同系物的是:
A.乙二醇和丙三醇 B.C6H5一OH和C6H5一CH2OH C.C3H6和C4H8 D. C2H6和C10H22
5.下列各组物质只用水不能鉴别开的是
A、CuSO4、Na2CO3、CaC2三种固体粉末 B、CH3OH、CH3CHO、![]() 三种液体
三种液体
C、![]() 、CH3CH2OH、CCl4三种有机溶剂
D、NaOH、NH4NO3、NaCl三种固体
、CH3CH2OH、CCl4三种有机溶剂
D、NaOH、NH4NO3、NaCl三种固体
6.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A、4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B、2Fe+2H2O+O2=2Fe(OH)2↓
C、2H2O+O2+4e=4OH-- D、Fe-3e=Fe3+
7.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
8.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt 等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
二、不定项选择题(本题包括8小题,每小题3分,共24分。每小题有一个或二个选项符合题意。)
9. 2007年11月江苏省出现了首例因“禽流感”致死亡的病人,寻找抗禽流感病毒特效药物显
得更加重要,通过从香料八角中提取的莽草酸制得的达菲就是抗禽流感病毒特效药物之一。则下
列描述正确的是
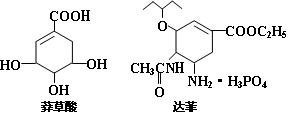
A、高温、紫外线都能使禽流感病毒失去生理活性
B、莽草酸既能与H2发生加成,又能与FeCl3溶液反应显紫色
C、莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色
D、1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为4mol
10.有机物A在一定条件下能发生水解反应生成两种有机物,B中①~⑥是标出该有机物分子中不同的化学键,在水解时,断裂的键是
A 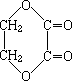 B
B 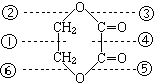
A ①、④ B ③、⑤ C ②、⑥ D ②、⑤
11.电解CuSO4溶液时,要求达到三点:(1)阳极质量减少;(2)阴极质量增加;(3)电解质溶液中c(Cu2+)不变,则可选用的电极是
A.纯铜作阳极,含Zn、Ag的铜合金作阴极
B.含Zn、Ag的铜合金作阳极,纯铜作阴极
C.用纯铁作阳极,纯铜作阴极
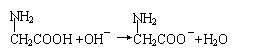 D.用石墨作阴极,纯铜作阳极
D.用石墨作阴极,纯铜作阳极
12.下列离子方程式正确的是
A.甘氨酸与氢氧化钠溶液反应:
B.高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O
C.苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
D.将氢氧化钠溶液滴加到氯化铁溶液中制备Fe(OH)3沉淀:Fe3++3OH-= Fe(OH)3↓
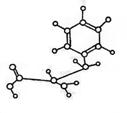 13.下图是某有机物(由C、H、O、N四种元素组成)的球棍模型,下列关于
13.下图是某有机物(由C、H、O、N四种元素组成)的球棍模型,下列关于
该有机物的性质叙述中错误的是
A.能与NaOH溶液发生反应,也能与盐酸反应 B.能发生加成反应
C.能合成高分子化合物 D.能发生水解反应
14、下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量
是定值的是
A、CH2=CH2、C2H5OH、HOCH2CH2COOH B 、 CH2O、C2H4O2、C6H12O6
C、C6H6、C5H10、C7H6O2 D 、 H2、CO、CH3OH
15.下列反应可由1,3-丁二烯制备酒石酸 HOOC-CH(OH)-CH(OH)-COOH的正确流程是
A.加成、取代、氧化、加成、氧化 B、加成、取代、加成、氧化、氧化、取代
C.加成、取代、氧化、氧化、加成 D、加成、氧化、取代、氧化、加成、取代
16.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电
电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,
下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、放电时正极反应为:Fe(OH)3 -3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
三、本题包括3小题,共32分
| 甲 | HCOOCH2CH3 HCOOH C6H5OH |
| 乙 | [Ag(NH3)2]OH CH3CH2OH NaOH |
17.(1) (4分)有甲、乙
两组物质
甲组中的 能跟乙组中的所有物质发生反应;
乙组中的 也能跟甲组的所有物质发生反应。
(2)(8分)下列图示的装置或操作中均有1~2处明显的错误,用简洁的语言指出错误,将其填入对应装置下方的空格中。
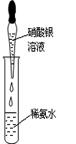
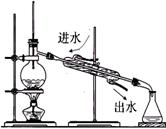
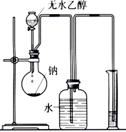
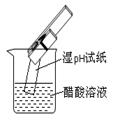
| ①银氨溶液 的配制 | ②实验室蒸馏石油 | ③测定乙醇跟钠反应放出氢气体积的装置 | ④测醋酸溶液的PH |
|
|
|
|
|
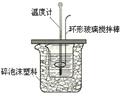 18.(10分)某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol·L-1
18.(10分)某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol·L-1
氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,试分析此操作步骤对实验测定中和热的影响 。(只需答出一例)
19.(10分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴ 化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
⑵ 已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
⑶ 有下图所示的装置:
该装置中Cu极为 极;当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状
况下的体积为
L.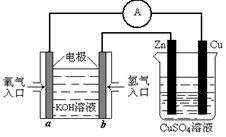
四、本题包括2小题,共32分。
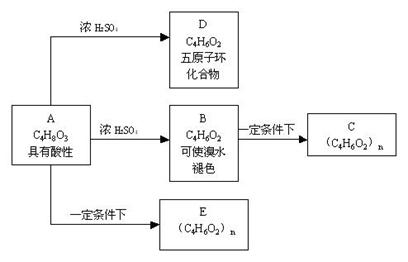 20、(13分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
20、(13分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
试写出:
⑴化学方程式A→D
,
B→C
,
⑵反应类型:
A→B ,B→C
, A→E
,
⑶E的结构简式: ;
A的结构简式的同分异构体(同类别且有支链)的结 构简式: 及
21.(19分)(1)已知:反应CH3C≡CCH3+2H2→CH3(CH2)2CH3 △H=-278kJ/mol
反应CH2=CH-CH=CH2+2H2→CH3(CH2)2CH3 △H=-239kJ/mol
提示:化学反应总是向能量降低的方向进行
如果CH3CHBrCHBrCH3与NaOH醇溶液共热后的主要产物是A,
A的结构简式为
(2)某有机化合物X(C12H13O6Br)遇FeCl3溶液显紫色,其结构简式如下
![]()
X在足量的NaOH水溶液中加热反应得到A、B、C、D四种物质,A中有两种氢原子,C中只有一种氢原子。D不含氢原子。则A、B、C的结构简式为:
A ,B ,C 。D
(3)化学式为C5H4的烃,理论上同分异构体的数目可能有30多种。如:
① CH2=C=C=C=CH2 ② CH≡C-CH=C=CH2
③ ![]() ④
④ ![]() -C≡CH ⑤
-C≡CH ⑤
![]() -CH=CH2……
-CH=CH2……
请不要顾忌这些结构能否稳定存在,完成下面各小题:
Ⅰ、异构体①、②是链状分子,请再写出2种链状分子的结构简式:
,_______________ _______。
Ⅱ、若核磁共振表明氢原子的化学环境没有区别,则满足条件的异构体
除①、③外还有 _____ ____ 。(只需答出一例的结构简式)
五、本题1小题,共8分。
22.(8分)将1L一定浓度的CuSO4溶液用a、b两个石墨电极电解,当a极上产生22.4L(标准状况)气体时,b极上只有固体析出。然后将电极与电源反接继续通电,b极上又产生22.4L(标准状况)气体,溶液质量共减轻227g。计算:
(1)第一次电解时,b极增加的质量
(2)原溶液的物质的量浓度
高二化学(选修)答卷纸
姓名: 得分:
选择题答题栏:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
|
|
|
|
|
17.(8分,每空2分)
①应向AgNO3溶液中逐滴加入稀氨水,且胶头滴管不能插入试管中;
②温度计的水银球应位于蒸馏烧瓶的支管处,且冷凝水的流向应从下口进、上口出;
③广口瓶中的进气导管应短一些,出气导管应长一些;
④pH试纸不能先润湿,且不能将pH试纸直接插入待测溶液中。
18.(1)偏低 (2分) (2)△H=-56.01kJ/mol;(2分)
(3)偏低,用醋酸代替盐酸,由于醋酸电离要吸收,造成测得的中和热数值偏低。(3分)
(4)洗涤温度计的操作会使中和热数值偏低;(本设问是开放型的,若考生回答言之有理可酌情给分)(3分)
19.
⑴ 434 kJ·mol-1
⑵ FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
⑶ 阳 2.24L
(10分)
21.(1) CH2=CH-CH=CH2 (2) HOCH2CH2OH;NaOOCCH2CH(OH)COONa
NaO-C6H4 ONa ;NaBr
22、 128g 2.5 mol/L