高二化学3月调研考试试卷
一、选择题(每小题只有一个正确选项)
1.2008年奥运会将在北京举行,届时可能会用大型遥控飞艇作为宣传工具以渲染活动气氛,为了使飞艇在空中安全而有效,你认为飞艇内充入哪种气体最好( )
A.氮气 B.氦气 C.氢气 D.二氧化碳
2.下列有关环境污染的说法不正确的是( )
A.SO2、NO2或CO2的大量排放都会导致酸雨的形成
B.氟氯烃等化合物的大量排放会破坏大气臭氧层
C.重金属、有机农药和工业废水的任意排放等会造成水体污染
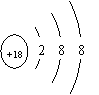 D.装饰材料中的甲醛、苯和放射性元素氡等会造成居室污染
D.装饰材料中的甲醛、苯和放射性元素氡等会造成居室污染
3.下列叙述中正确的是( )
A.一个D218O分子所含的中子数为10 B.S2-的结构示意图:
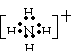 |
C.NH4+ 的电子式为: D.热稳定性:H2S›H2O›HF
4.下列几种化合物受热分解时(超过100℃)只生成一种气体的是( )
A.NH4HCO3 B.HNO3 C.KClO3 D.NaHCO3
5.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。下列说法中不正确的是( )
A.S8、S6、S4、S2互为同素异形体
B.不论哪种硫分子,完全燃烧时都生成SO2
C.常温条件下单质硫为分子晶体tx
D.S8与S6、S4、S2的转化是物理变化
6.下列对实验现象的描述正确的是( )
A.Na在空气中燃烧产生苍白色的火焰
B.Cu在氯气中燃烧产生绿色的烟
C.氢氧化钡晶体与氯化铵晶体混合,能够吸收环境的热量
D.在滴有紫色石蕊试液的溶液中通人二氧化硫,溶液的颜色变化是先变红后褪为无色
7.已知下列氧化剂都能氧化+4价硫元素,为了除去稀硫酸中混有的少量H2SO3 ,以得到纯净的稀硫酸,最合理的氧化剂是( )
AKmnO4 BCa(ClO)2 CH2O2 DCl2
8.设NA代表阿伏加德罗常数,以下说法正确的是
A. 标准状况下,22.4 L甲烷和氮气混合物所含的分子数为N
B.常温常压下1 mol NO2气体与水反应生成NA个NO![]() 离子
离子
C. 标准状况下,1 L水所含分子数为![]() NA
NA
D.78 g Na2O2溶于水后所得溶液中含有O2![]() 离子数为NA
离子数为NA
9、已知某元素的最高化合价为+7价,下列说法中正确的是( )
A.该元素在元素周期表中一定处于ⅦA族
B.该元素可能是氟元素
C.该元素的某种化合物可能具有漂白性
D.该元素的单质没有还原性
10.如右图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子可发现试管①中的水立刻沸腾了。
夹子
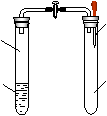 则液体A与气体B的组合不可能是 ( )
液体A
则液体A与气体B的组合不可能是 ( )
液体A
A.NaOH溶液和SO2 空气
B.NaOH溶液和NO (标准大气压下)
C.水和NH3 99℃的水 气体B
D.水和NO2
① ②
11.对现有元素周期表的下列说法中,正确的是 ( )
A.主族都含有非金属元素 B.主族都含有金属元素
C.最外层电子数为2的都是金属元素 D.副族都是金属元素
12.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关,下列各组物质:
①Cu与HNO3溶液 ②Fe与盐酸 ③Zn与H2SO4溶液 ④Cl2与FeCl2溶液
由于浓度不同而能发生不同氧化还原反应的是( )
A.①②③ B.①③④ C.①③ D.①②③④
13.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH=13;
②取少量溶液加入过量稀盐酸,产生无刺激性、能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至不再产生沉淀时,再滴加AgNO3溶液,产生
白色沉淀。
|
A.溶液中一定有CO32-
B.溶液中一定有SO42-
C.不能确定溶液中是否存在HCO3-
D.不能确定溶液中是否存在Cl-
14.由两种短周期元素构成的某常见离子化合物,阴阳离子所含的电子数不相等。关于该离子化合物的下列说法中正确的是( )
①晶体中阴阳离子的数目之比一定是1:1
②两元素可以在同一周期也可在不同周期
③晶体内一定只有离子键没有共价键
④阴离子的电子数一定大于阳离子的电子数
A.② B.②④ C.②③④ D.①②③④
15.将相同质量的锌分别和过量浓硝酸、浓硫酸反应,下列叙述正确的是( )
A.反应生成气体的颜色:两者相同
B.反应消耗酸的物质的量:前者少,后者多
C.反应生成气体的物质的量:前者多,后者少
D.反应中转移的电子总数:前者多,后者少
二、填空题
16、(6分) 利用右图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
利用右图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1) 通过挤压胶头滴管和控制活塞的开关,若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是 。
(2) 通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是 。
17.(12分)某同学为研究硫酸的性质,设计了如下图实验。检查好装置的气密性后,在甲的试管中加入足量的铁片,然后,加入少量浓硫酸。
(1)在未点燃酒精灯时,乙中没有明显现象,这是因为__________________
_________ _;为处理生成的有毒气体,还应在乙、丙之间接入 __________(填仪器名称),并在其中填充足量的 。
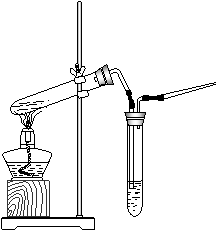 (2)接入该仪器后,点燃酒精灯,开始时发生反应的化学方程式为:
(2)接入该仪器后,点燃酒精灯,开始时发生反应的化学方程式为:
Fe 浓硫酸 丙
品红溶液
甲 乙
__________________________________________________;反应开始一段时间后,在丙处检验到某种无色无味气体,它是__________。
(3)设计简单实验,通过观察丙处现象,判断甲中反应基本结束,请简述操作及有关现象:_________________________________________________________________________
_________________________________________________________________________.
18.(8分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A | B | ||||||
| C | D | ||||||
| E | F | G |
(1)“钻石恒久远,一颗永流传。”这句广告词被美国《广告时代》评为21世纪的经典广告之一,说的是上述元素中的 (填字母)的一种单质,该广告词最能体现钻石的性质是下列中的 (填字母)。
a.硬度大 b.不能导电 c.化学性质稳定 d.熔点低
(2)上述元素中,原子半径最大的是 (填字母)。
(3)上述另一种元素,其原子获得一个电子所释放出的能量是上表所列元素中最大的,则该元素是 (填字母)。
19.(9分)A、B、C、D均为中学化学中的常见物质,且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其它产物已略去):
![]()
(1)若A为周期表中短周期元素形成的单质,D为强碱,则A元素在周期表中的位置是 _________________ ,D的电子式为: 。
(2)若A为极性分子,其水溶液能使红色石蕊试纸变蓝,D的稀溶液能使蓝色石蕊试纸先变红后褪色。写出工业上合成A的化学方程式: ____________________ 。
(3)若A为短周期元素形成的非金属单质,则A元素可能是 __________________(填两种不同的单质的化学式)
20.(本题12分) 在下图所示的转化关系中,A是一种固体单质,F是一种气体单质,E是一种白色沉淀。
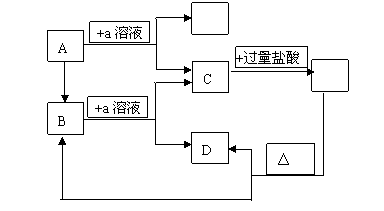

据图填写:
(1)B 的化学式: ,
列出B的一项在现代科技生产中的主要用途: ;
(2)B和a溶液反应的离子方程式: ;
(3)C与过量盐酸反应的离子方程式: 。
(4) 若将图中的过量盐酸改为少量盐酸,则符合题意的A还可以是 。
三、计算题:
21.(8分)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,在炼铜炉内发生如下反应(在高温条件下进行):
2Cu2S+3O2=2Cu2O+2SO2; 2Cu2O+Cu2S=6Cu+SO2↑
(矿石与空气按一定的比投入炼铜炉内反应)
(1)若生成38.4t金属铜,需要含杂质20%的精辉铜矿多少吨(按恰好反应计算,且杂质不参加反应)?
(2)若(1)中产生的二氧化硫用于制备硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
答案:
1.解析:B 要同时考虑气体的密度和安全性。
2.解析:A CO2的大量排放会导致“温室效应”,不会导致酸雨的 形成。
3.解析:C 一个D218O分子所含的中子数为12;S2-的核电荷数为16;热稳定性:H2S<H2O<HF。
4.解析:C KClO3受热只生成氧气。注意:100℃以上水为气态。
5.解析:D S8、S6、S4、S2互为同素异形体,是硫的不同的单质,因此它们之间的 转化为化学变化。
6.解析:C Cu在氯气中燃烧产生棕黄色的烟,二氧化硫不能使石蕊试液褪色。
7.解析:C 用H2O2作氧化剂不会引入杂质。
8.解析:A 1 mol NO2气体与水反应生成1/3 molHNO3; 标准状况下,水为液态,1 L水所含分子数为1000/18 NA。
9、解析:C最高化合价为+7价的也可能是副族的锰元素(KMnO4), 氟元素是自然界氧化性最强的元素,最高价为0价,除氟元素外的 其他卤族元素兼有氧化性和还原性,以氧化性为主。
10. 解析:B 让试管①中的水沸腾的 条件就是其上方的压强减小,因此气体B应易溶于液体A或二者发生反应使密闭体系的 压强减小。B中NO不溶于水也不能于NaOH反应,符合题意。
11.解析:D 第IIA族都是金属元素,第IIVA族都是非金属元素,最外层电子数为2的也可能是He.
12.解析:C 硝酸的浓度越大氧化性越强,因此浓度不同还原产物不同(一般浓硝酸的还原产物为NO2,稀硝酸的还原产物为NO,更稀一点的 硝酸的还原产物为N2);稀硫酸中起氧化作用的是H+,其还原产物是H2,浓硫酸中起氧化作用的 是+6价的硫,其还原产物是SO2,浓盐酸与稀盐酸的还原产物均为H2.
13.解析:C 由溶液的pH=13可知溶液中不存在HCO3-,会发生反应:HCO3-+H+=CO32-+H2O;因此C项判断错误。
14.解析:A 可以用排除法,Na2S、MgCl2中阴阳离子所含的电子数不相等, 排除①;NaOH、Na2O2等晶体中既有离子键又有共价键, 排除③; Na2S中阳离子的电子数大于阴离子的电子数,排除④。
15.解析:C Zn~4HNO3(浓)~2NO2(红棕色)
Zn~2H2SO4(浓)~SO2(无色)
16.(6分)
(1) 先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞) (3分)
(2) 先打开a、c活塞,再挤压胶头滴管(活塞与滴管操作顺序可换)。片刻后,关闭a,然后打开b活塞。 (3分)
17.(1)常温下,Fe遇浓硫酸钝化;(2分)干燥管(2分);碱石灰(2分)
(2)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O (2分);
氢气(或H2)(1分)
Fe2(SO4)3+3SO2↑+6H2O (2分);
氢气(或H2)(1分)
(3)经检验丙处气体(H2)纯净后,点燃,待其火焰熄灭后,甲中反应基本结束(3分)
18. (1)C(2分);c(2分)
(2)E(2分)
(3)G(2分)
![]() 19. (1) 第三周期、第ⅠA族(2分) ; Na+
O H (2分)
19. (1) 第三周期、第ⅠA族(2分) ; Na+
O H (2分)
![]() (2)N2
+ 3H2
2NH3 (2分)
(2)N2
+ 3H2
2NH3 (2分)
(3) C、S(N2、P或P4)(3分)
![]() 解析:中学化学中能够发生A B C 的连续氧化的常见物质有金属单质钠和铁;非金属单质C、N2、S、P或P4;化合物H2S、NH3等。
解析:中学化学中能够发生A B C 的连续氧化的常见物质有金属单质钠和铁;非金属单质C、N2、S、P或P4;化合物H2S、NH3等。
20.答案:(1) SiO2 (2分); 制造光导纤维(2分) (2)SiO2+2OH-=SiO32-+H2O(3分) (3) SiO32-+2H+=H2SiO3 ↓(3分) (4) Al (2分)
解析:短周期元素中,单质及其氧化物都能与NaOH溶液反应的元素只有Al和Si.
21.解析:(1) Cu2S→2Cu m(精辉铜矿)=60t(3分)
(2) Cu2S→H2SO4
m[H2SO4 (浓)]=60t×80%×92%×98%×98/160×98%=27t(5分)