高二化学上学期期末考试模拟试卷一 姓名
一、选择题(每小题只有一个正确选项)
1.下列说法或表示正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) △H=+1.19kJ/mol,可知金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含1molCH3COOH的溶液与含1molNaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol
2.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体 B.X和Y可属于同一周期,也可属于两个不同周期
C.若Y的原子序数为m,X的原子序数可能是m±4
D.X和Y一定不属于同一主族
3.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,
HA-![]() H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是( )
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是( )
A.因为A2-+H2O ![]() HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
4.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是 ( )
A.弱碱的浓度大于强酸的浓度 B.反应后的溶液呈酸性
C.原氨水中有1%的含氮微粒为NH4+
D.反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05mol·L-1
5.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10—8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10—5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c (K+)>c (NO3—) >c (Cl—) >c (Ag+)>c (I—)
B.c (K+)>c (NO3—) >c (Ag+) >c (Cl—)>c (I—)
C.c (NO3—)>c (K+)>c (Ag+) >c (Cl—)>c (I—)
D.c (K+)>c (NO3—) >c (Ag+) = c (Cl—) + c (I—)
6.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
![]() 2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
( )
2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
( )
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3
二、选择题(每小题可能有1-2个正确选项)
7.下列各项所述的数学不是6的是 ( )
A.在NaCl晶体中,与一个Na+距离最近且相等的Cl-的个数
B.在金刚石晶体,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
8.通过比较归纳可以加深对问题的认识。下列比较或归纳一定正确的是 ( )
A.酸性:H2SO4>H3PO4>H2SiO3 B.稳定性:NH3<PH3<AsH3
C.离子半径:阴离子>阳离子 D.熔沸点:离子化合物>共价化合物
9.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
10. 用0.100mol·L-1的硫酸溶液滴定20.0mL0.100mol·L-1的氢氧化钡溶液,并绘制酸碱滴
定曲线必须选用的仪器是 ( )
A.pH计 B.胶头滴管 C.滴定管 D.量筒
11.Pt(NH3)2Cl2(相对分子质量为300)有两种同分异构体,其顺式结构是临床广泛使用的搞肿
瘤药物。下列有关该物质的说法中正确的是 ( )
A.中心原子的配位数为4 B.含有NH3分子
C.Pt的化合价为+4 D.Pt(NH3)2Cl2是平面四边形结构
12.叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质,3mol NaN3受撞击会生成4mol 氮气和一种离子化合物(Na3N).下列有关叙述错误的是 ( )
A.NaN3受撞击时,NaN3既是氧化剂又是还原剂
B.NaN3跟水反应时,有NH3生成
C.Na3N中N3-半径比Na+半径大
D.NaN3中,既存在离子键又存在非极性共价键
13.在一个1L的密闭容器中加入2molA和1molB,发生下述反应:
2A(g)+B(g)![]() 3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L。维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是
( )
3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L。维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是
( )
A. 4molA+2molB B. 3molC+1molD
C. 2molA+1molB+1molD D. 1molA+0.5molB+1.5molC+0.1molD
14.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
A、加少量烧碱溶液 B、升高温度 C、加少量冰醋酸 D、加水
15.在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。则下列叙述正确的是 ( )
A.在实验过程中水的电离程度的变化趋势是先减小后增大
B.当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)=c(Cl-)
C.当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl
D.若滴加盐酸后,溶液pH >7,则此时溶液中溶质一定是NH4Cl和NH3·H2O
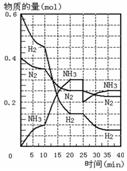 16.500℃、20MPa时,将H2和N2置于一容积为2L的密闭
16.500℃、20MPa时,将H2和N2置于一容积为2L的密闭
容器中发生反应。反应过程中H2、N2和NH3物质的量变化
如右图所示,下列说法正确的是 ( )
A.反应开始到第一次平衡时,N2的平均反应速率为 0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min时,分离出0.1mol的氨气
D.在25min时平衡正向移动,但达到新平衡后NH3的体积分数比原平衡小
三、填空题
17.下图是元素周期表中的前四周期,回答下列问题:
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | |||||||||||||||||
| ⑧ | |||||||||||||||||
⑴按原子轨道的重迭方式,①与④形成的化合物中的共价键属于 键。
⑵②、⑤、⑥、⑧4种元素第一电离能由高到低的顺序是 (用元素符号表示)。
⑶元素④形成的单质的晶体类型可以是原子晶体如 (填写物质名称),也可以是 如C60。
⑷元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这2种化合物分子的立体结构明显不同。③、⑥2种元素形成的化合物分子的立体结构为 ,⑦的氢化物分子的立体结构为 。
⑴ σ ⑵ F N Be K ⑶ 金刚石 分子晶体 ⑷ 平面三角形 三角锥形
18.水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
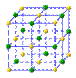

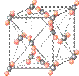
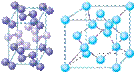
A B C D E
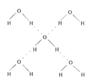 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),
已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华
力(11 kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一
种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
 (1)1S22S22P4;(2分)(2)H2S或NH2-;(2分)
(1)1S22S22P4;(2分)(2)H2S或NH2-;(2分)
(3)A;(2分)(4)BC;(2分)(5)20; (2分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
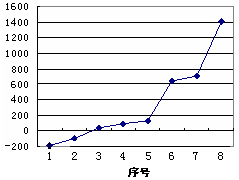
19.(1)第三周期8种元素按单质熔点高低的顺序如右图,
其中序号“8”代表 (填元素符号);其中电负
性最大的是 (填右图中的序号)。
(2)请写出比元素1的原子序数大8的元素的基态原子电
子排布式 。
(3)元素7的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
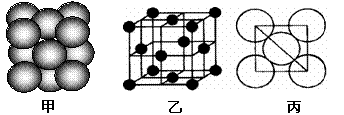

若已知7的原子半径为d,NA代表阿伏加德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为___ ___ _ ,一个晶胞中7原子的数目为_ _;
②该晶体的密度为______ _ (用字母表示)。
(1)Si; 2 2分
(2)1s22s22p63s23p63d64s2 2分
(3)① 12; 4 2分 ② 2分
四、计算题
20.在一定温度下,向一个容积不变的密闭容器中加人 2 molA 和 2 molB ,发生反应:
2A ( g ) + B ( g )![]() 3C ( g ) ;ΔH=-akJ/mol 。在该条件下达到平衡时放出的热量为 bkJ , B 的体积分数为ω1%。若向此平衡容器中再充人 1 molB 和 3 mo1C ,在相同温度下达到平衡时 B 的体积分数为ω2 % ,反应过程中吸收的热量为c kJ 。则:
3C ( g ) ;ΔH=-akJ/mol 。在该条件下达到平衡时放出的热量为 bkJ , B 的体积分数为ω1%。若向此平衡容器中再充人 1 molB 和 3 mo1C ,在相同温度下达到平衡时 B 的体积分数为ω2 % ,反应过程中吸收的热量为c kJ 。则:
(1)ω1% ω2 % (填“ > ”、“=”或“ < " )。
(2)b c (填“ > ”、“=”或“ < ”或“不确定”)。
(3)a 、 b 、c三者的数学关系为 (用不等式或等式表示)。
(4)若A、B、C的起始加入量分别为xmol、ymol、zmol,达平衡时B的体积分数仍为
ω1%,则x、y、z应满足的关系是 ,设第一次达到平衡时A的物质的量为n,则现状况下达到平衡时A的物质的量为 mol(用n、x、z表示)。
20.(1) == ; 1分 (2) 不确定; 1分
(3)a = b + c 2分
(4) Y = X + Z/3 (X + 2Z/3)n/2 4分
21.我国中医药已有数千年历史,其独特的疗效使得经深加工的中药商品正逐步进入国际市场,但国外在进口中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素砷的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2~3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测定溶液至终点,消耗20.25ml 标准I2溶液,其中发生反应:
H3AsO3+I2+H2O→H3AsO4+I-+H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?______________________
(2)配平离子反应方程式:___H3AsO3+___I2+H2O —___H3AsO4+____I-+____H+
(3)0.2%的淀粉溶液的作用是__________,如何判断滴定到达终点?_____________。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000mL而制得,请用一个离子反应方程式说明标准碘溶液形成过程_____________。
(5)我国《药用植物及制剂进口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为_______mg/kg,故该草药样品_________(填“合格”或“不合格”)。
(1)取少量样品于坩埚内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液(2分)。
(2)1,1,1,1,2,2(2分)
(3)作为指示剂以判断滴定的终点(1分);溶液由蓝色变为无色,保持半分钟不变色(1分)。
(4)IO3- + 5I- + 6H+ = 3I2 + 3H2O(2分)
(5)在2.278mg/kg到2.279mg/kg范围内均可得分(2分);不合格(1分)