高二化学上学期期末考试试卷
时量:90分钟 分值: 100分
命题:张中华 审核:胡和平
可能用到的相对原子质量: Fe:56 Mg:24 Al:27 O:16 N:14 H:1
一、选择题(每小题2分,共40分,每小题均只有一个选项符合题意)
1、碳原子数很多且碳原子数相等的固态烯烃、炔烃、烷烃,它们燃烧时冒出黑烟的
情况,描述合理的是
A.炔烃的浓得多 B.烯烃的浓得多
C.几乎一样浓 D.无法确定
2.能区别氯化镁、氯化铝、硫酸铵、硫酸钾的一种试剂是
A.硝酸银 B.氯化钡 C.氢氧化钠 D.浓氨水
3.下列电离方程式中,正确的是
A.HClO4
== H++ClO4- B.H2CO3![]() 2H++CO32-
2H++CO32-
C.H2PO4-+H2O== HPO42-+H3O+ D.NH3·H2O == NH4++OH-
4.在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,则溶液的颜色
A.变蓝色 B.变深 C.变浅 D.不变
5.将等物质的量的Mg和Al混合均匀,分成四等份,分别加到下列四种过量的溶液中,充分反应后,放出H2最多的是
A.3mol/LHCl溶液 B.4mol/LHNO3溶液
C.8mol/LNaOH溶液 D.18mol/LH2SO4溶液
6.下列溶液一定是碱性的是
A.溶液中c(OH-)>c(H+). B.滴加甲基橙后溶液显红色.
C.溶液中含有OH--. D.滴加甲基橙后溶液显黄色.
![]()
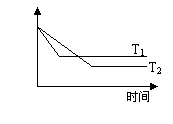 7.同压、不同温度下的反应:A(g)+B(g)
7.同压、不同温度下的反应:A(g)+B(g)![]() C(g),A的含量和温度的关系如右图所示,下列结论正确的是
C(g),A的含量和温度的关系如右图所示,下列结论正确的是
A.T1>T2, 正反应吸热
B.T1<T2, 正反应吸热
C.T1>T2, 正反应放热
D.T1<T2, 正反应放热
8.某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的反应式可表示为
A.X2+2Y2 ![]() 2XY2 B.2X2+Y2
2XY2 B.2X2+Y2![]() X2Y
X2Y
C.3X2+Y2![]() 2X3Y D.X2+3Y2
2X3Y D.X2+3Y2![]() 2XY3
2XY3
9.下列方法不能用于进行金属防腐处理的是
A.油漆 B.铝热反应 C.电镀 D.改变金属内部结构
10.实验室欲快速制取H2,最好的方法是采用
A.纯锌与1.0mol/L稀硫酸反应
B.纯锌与1.0mol/L稀盐酸反应
C.粗锌(含少量铜)与1.0mol/L稀硫酸反应
D.粗锌(含少量铜)与1.0mol/L稀醋酸反应
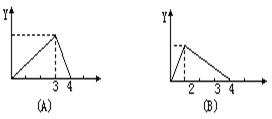
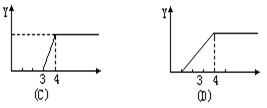
11.在NaOH溶液中加入AlCl3溶液中,得到沉淀的量(Y)与所加AlCl3溶液的体积(X)的函数图象正确的是
12.中和滴定中,眼睛应注视的是
A.滴定管内的液面变化 B.液滴滴出的速度
C.滴定管刻度 D.锥形瓶中溶液颜色变化
13.某溶液中含有大量的Fe2+、Fe3+、Mg2+和NH4+,其中c(H+)= 10-2mol/L,在该溶液可以大量共存的阴离子是
A.SO42- B.NO3- C.SCN- D.CO32-
14.工业制硫酸中,存在可逆反应2SO2(g)+ O2(g)![]() 2SO3(g),在已达到平衡后充入少量18O2后,一段时间后18O存在于
2SO3(g),在已达到平衡后充入少量18O2后,一段时间后18O存在于
A.O2 B.O2和SO2 C.O2和SO3 D.SO2、O2和SO3
15.人造地球卫星用到一种高能电池——银锌蓄电池,其电极反应式为:
Zn+2OH—-2e—==ZnO+H2O,Ag2O+H2O+2e—==2Ag+2OH—。据此判断氧化银(Ag2O)是
A.负极,被氧化 B.正极,被氧化 C.负极,被还原 D.正极,被还原
16.下列情况下,铁片腐蚀最快的是
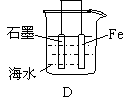 | |||||||
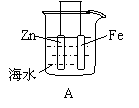 | |||||||
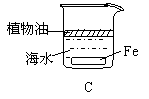 | |||||||
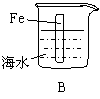 | |||||||
17.等质量的下列各烃完全燃烧时,消耗氧气最多的是
A.CH4 B.C2H6 C.C3H6 D.C6H6
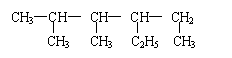
18.某烷烃的结构为: ,下列命名正确的是
A.1,2-二甲基-3-乙基戊烷 B.3-乙基-4,5-二甲基已烷
C.4,5-二甲基-3-乙基已烷 D.2,3-二甲基-4-乙基已烷
19.铝在人体内积累可使人慢性中毒,引起老年痴呆症。1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。铝在下列使用场合中一般无须控制的是:①牙膏皮质 ②制造炊具 ③电线电缆 ④糖果包装 ⑤航天器材
A.①④ B.②③ C.③⑤ D.④⑤
20.对于在一密闭容器中进行的反应:C(s)+O2(g)===CO2(g),下列说法中错误的是
A.将木炭粉碎成粉末状可以加快化学反应速率
B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率
D.增加木炭的量可以加快化学反应速率
二.填空题(每空2分,共32分)
21.下列各组物质 ① O2和O3 ② H2、D2、T2 ③ 12C和14C ④ CH3CH2CH2CH3 和(CH3)2CHCH3 ⑤乙烷和丁烷 ⑥ CH3CH2CH2CH(C2H5)CH3 和 CH3CH2CH2CH(CH3)C2H5
根据题意填空(只填序号),互为同系物的是______,互为同分异构体的是______,互为同位素的是_____,互为同素异形体的是________。
22.在金、钠、铁、铝几种金属中,在空气中最稳定的是 ;最活泼的是 ;既能与酸反应又能与碱反应的是 ;适合于用热还原法冶炼的是 。
23.在配制Al2(SO4)3溶液时,铝离子会部分水解而使溶液呈酸性,水解的离子方程式为: 。为了防止发生水解,可以加入少量的 。

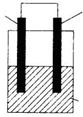 24.化学电源在通讯、交通以及生活中有着广泛的应用。下图装置由镁条、铝条和某种电解质溶液组成。(1)若电解质溶液为稀硫酸,则原电池的负极为 ,其电极反应式为
,正极现象是
。当导线中有0.6mol电子通过时,消耗负极材料的质量是
g。(2)若电解质为NaOH溶液,则两极的电极反应式分别为:负极
,正极
。
24.化学电源在通讯、交通以及生活中有着广泛的应用。下图装置由镁条、铝条和某种电解质溶液组成。(1)若电解质溶液为稀硫酸,则原电池的负极为 ,其电极反应式为
,正极现象是
。当导线中有0.6mol电子通过时,消耗负极材料的质量是
g。(2)若电解质为NaOH溶液,则两极的电极反应式分别为:负极
,正极
。
三.实验题(每空2分,共8分)
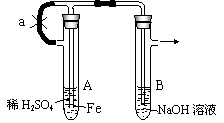 25.根据下图实验装置和操作,回答有关问题:
25.根据下图实验装置和操作,回答有关问题:
按右图所示装置进行实验,观察B中现象。
操作(1):先夹止水夹a,使A管开始反应。在B管中观察到的现象 ,B中发生的主要的化学反应有2NaOH + H2SO4 == Na2SO4 + 2H2O,还有 ,
。
操作(2):打开止水夹a,使A管开始反应一段时间后再夹紧a,实验中在B管中观察到的现象是 。
四.推断题(每空2分,共12分)
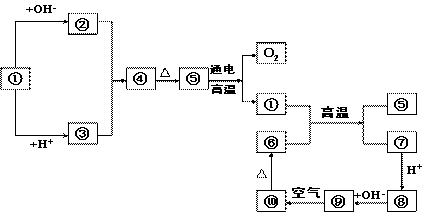
|
(1)分别写出①、④、⑧、⑩的化学式或离子符号:
① ;④ ;⑧ ;⑩ 。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
|
![]() ① + ⑥
① + ⑥
五.计算题(8分)
27、某气态烃含C85.7%,含H14.3%,在标准状况下的密度是2.5g/L。
该烃能使酸性高锰酸钾溶液或溴水褪色。求该烃的分子式,并写出它的各种同分异构体的结构简式。
答题卡
|
|
二、填空题(每空2分,共32分)
21. , , , 。
22. , , , 。
23. , 。
24.(1) , 。
___________________________________________,_________________。
(2) , 。
三、实验题(每空3分,共12分)
25. ____________________________________________________________________________,
, , 。
四、推断题(每空2分,共12分)
26、(1)① ;④ ;⑧ ;⑩ 。
|
![]() ① + ⑥
① + ⑥
五、计算题(8分)
参考答案
1.C 2.C 3.A 4.C 5.A 6.A 7.C
8.C 9.B 10.C 11.C 12.D 13.A 14.D
15.D 16.D 17.A 18.D 19.C 20.D
21.⑤,④,③,①。
22.金;钠;铝;铁。
23.Al3+
+ 3H2O![]() Al(OH)3
+ 3H+,稀硫酸
Al(OH)3
+ 3H+,稀硫酸
24.Mg , Mg – 2e- == Mg2+ ,有气泡生成,7.2g。2Al+8OH-– 6e- ==2AlO2-+4H2O,6H2O + 6e- ==3H2↑+6OH-
25、操作(1):液面升高开始有白色沉淀,随后白色沉淀迅速变灰绿色,最后变红褐色;
2NaOH + FeSO4 == Na2SO4 + Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
操作(2):液面升高产生白色沉淀。
26、(1) ①Al ④Al(OH)3 ⑧Fe2+ ⑩Fe(OH)2
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑,2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
27.C4H8 CH2=CH-CH2-CH3 CH3-CH=CH-CH3 CH2=C(CH3)2