高二化学上学期第二学段考试试卷
选修五、选修三(专题一)
(考试时间:120分钟 总分值:100分)
命题人:黄青华 审核人:高二备课组
相对原子质量:H-1 C-12 N-14 O-16 Cu-64 Zn-65 Ag-108
一、选择题(每小题2分,共40分;每小题只有一个正确选项)
1.即将在北京举行的2008年奥运会提出了“科技奥运、人文奥运、绿色奥运”的口号。为了使北京奥运会办成绿色奥运会,下列做法不可取的是( )
①开发新能源,减少矿物燃料的燃烧 ②关闭所有的化工企业 ③提倡使用一次性发泡塑料餐具和塑料袋 ④开发、生产无汞电池 ⑤机动车安装尾气净化器
A.①②③ B.③④⑤ C.①④ D.②③
2.下列有机物命名正确的是( )
A. ![]() 2-乙基丙烷 B. CH3CH2CH2CH2OH 1-丁醇
2-乙基丙烷 B. CH3CH2CH2CH2OH 1-丁醇
C. CH3-![]() -CH3 间二甲苯
D.
-CH3 间二甲苯
D. 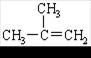 2-甲基-2-丙烯
2-甲基-2-丙烯
3、食品卫生与身体健康密切相关,下列做法会导致食品对人体有害的是( )
①在沥青公路上翻晒粮食 ②香肠中加过量亚硝酸钠以保持肉类新鲜
③用生活用煤直接烧烤鸡、鸭 ④用“瘦肉精”(一种含激素的饲料) 喂饲生猪 ⑤用小苏打做发酵粉做面包 ⑥用福尔马林保鲜鱼肉等食品
A.①②③④⑥ B.①②③④⑤⑥ C. ①②③④⑤ D.①②③④
|
| A | B | C | D |
| 正极 | Zn | Cu | Zn | Fe |
| 负极 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
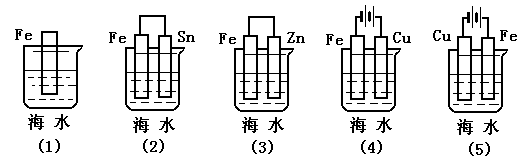
4.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是 ( )
5、洗涤盛放过植物油的试管,宜选用的试剂是( )
A、稀硫酸 B、热的碳酸钠溶液 C、热水 D、浓硝酸
6、下列植物的种子一般不选用来酿酒的有( )
A、葡萄 B、大麦 C、大米 D、花生
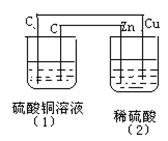 7.如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均0.1mol/L,
7.如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均0.1mol/L,
工作一段时间后,测得导线上通过了0.02mol e-。若不考虑溶液体积的变化下列叙述正确的是( )
A.相同条件下,两容器产生的气体体积相同
B.(1)、(2)溶液的pH值均减小
C.(1)中阳极电极反应方程式为:4OH-—4e-=2H2O+O2↑
D.(1)中阴极上析出0.02molCu
8、除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法
不能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙醇(水) | 新制CaO | 蒸馏 |
| D | 溴苯(溴) | NaOH 溶液 | 分液 |
9.已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( )KJ
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
|
![]()
|
A. Ag B. Zn(OH)2 C. Ag2O D. Zn
11.已知热化学方程式:SO2(g)+ O2(g) ![]() SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJ B. 196.64kJ/mol
C. <196.64kJ D. >196.64kJ
12. 某混合气体由两种气态烃组成,取2.24升该混合气体,完全燃烧得到4.48升二氧化碳和3.6克水(气体体积均在标准况下测定),则这种混合气体组成可能是( )
A.C3H4和CH4 B.C2H4和C3H4 C.C2H4和C2H6 D.C2H2和C3H6
13、能与KOH的醇溶液发生消去反应的是( )
![]()
![]() A.(CH3)3CCH2Cl B.CH3Cl C. Br D.
CH2Br
A.(CH3)3CCH2Cl B.CH3Cl C. Br D.
CH2Br
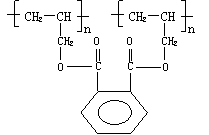 14、DAP是电器和仪表中常用的一种高分子化合物,其结构简式为:
14、DAP是电器和仪表中常用的一种高分子化合物,其结构简式为:
则合成该高分子化合物的单体可能是:
①邻苯二甲酸 ②丙烯醇 ③丙烯 ④乙烯
⑤邻苯二甲酸甲酯,正确的一组是:( )
A、①② B、④⑤ C、①③ D、③④
15、X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z极上有氢气放出;若Y2+和Z2+共存溶液中时,Y2+易得电子形成单质;又知M2+氧化性强于Y2+,则这四种金属的活动性由强到弱的顺序为( )
A. X>Z>Y>M B. X>Y>Z>M
C. M>Z>X>Y D. X>Z>M>Y
16.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是 ( )
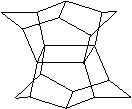 A、分子式为C20H20
A、分子式为C20H20
B、一氯代物的同分异构体只有两种
C、分子中含有二个亚甲基(—CH2—)
D、分子中含有4个五元碳环
17、某芳香族化合物A的分子式为C8H10O,它的结构中有两个甲基(-CH3),且它遇FeCl3溶液可发生显色反应,这样的结构共有:( )
A、4种 B、5种 C、6种 D、7种
18、如图的电解池中,a、b、c、d、都是石墨电极,通电
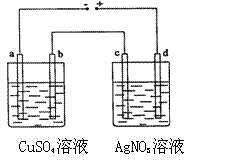 一段时间后,a、b、c、d、各电极上生成物物质的量
一段时间后,a、b、c、d、各电极上生成物物质的量
之比( )
A、2:1:2:1 B、1:1:2:1
C、2:1:4:1 D、1:2:4:1
19.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e- == Ni
B.电解后,电解槽底部的阳极泥中只有Cu和Pt
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解过程中,阳极质量的减少与阴极质量的增加相等
20、用铂作电极电解1 L含有0.4 mol CuSO4和0.2 mol NaCl的水溶液,一段时间后在一个电极上得到了0.3 mol Cu,在另一极上析出的气体在标况下的体积是( )
A.4.48 L B.5.6 L C.6.72 L D.13.44 L
二、选择题(本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
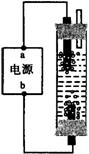 21.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
21.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
22.“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。其中没食子儿茶素(EGC)的结构如下图所示。关于EGC的下列叙述中正确的是 ( )
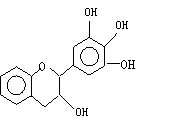 A、分子中所有的原子共面
A、分子中所有的原子共面
B、1molEGC与4molNaOH恰好完全反应
C、易发生氧化反应和取代反应,难发生加成反应
D、遇FeCl3溶液发生显色反应
23.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的金刚石与石墨完全燃烧,放出的能量一样多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量少
24、由甲醛、乙醛、丙醛组成的混合物中,氢原子占质量组成的9%,则氧原子
所占的质量百分比为:( )
A.37% B.16% C.6.6% D.无法确定
25、如图有关乙醇性质的下列叙述中,不正确的是;( )
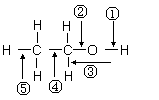 A、乙醇与钠反应时①键断裂
A、乙醇与钠反应时①键断裂
B、乙醇与HBr发生取代反应时②键断裂
C、乙醇催化氧化时②③键断裂
D、乙醇发生消去反应时②⑤键断裂
三、填空题:(共35分)
26.(3分)下列各情况,在其中Fe片腐蚀由慢到快的顺序是__________________________________
27.(8分)有机物A与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
28.(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
29.(6分)近年我国首创以Al──空气──海水为能源的新型电池,以海水为电解液.靠空气中的氧使铝不断氧化而产生电流.其工作时电极总反应式为:4Al + 3O2 + 6H2O = 4Al(OH)3;请判断:
(1)原电池的负极是______;
(2)工作时原电池的两极反应:A.负极______ ;B.正极______ ;
(3)工作时原电池正极附近pH______(增大,减小,不变).
30. (3分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)HX + 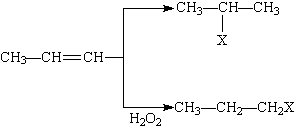
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被菌素原子取代。
工业上利用上述信息,按下列路线合成结构简式为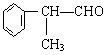 的物质,该物质是一种香料。
的物质,该物质是一种香料。
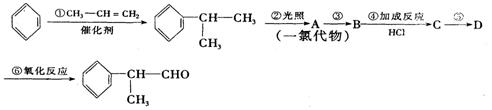
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是 。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
____________________________________________________________。
四、计算题(共10分)
31.(4分)在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ。现有2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为多少?
(注:某反应物的转化率=该反应物转化(消耗)的物质的量÷该反应物起始的物质的量×100%)
32.(6分)0.2 mol有机物和1.2 mol O2 在一密闭容器中恰好完全燃烧,产物依次通过浓H2SO4、碱石灰。浓H2SO4的质量增加18g,碱石灰固体质量增加35.2g,通过计算回答:
1)此有机物的分子式;
2)写出可能有的任意二种同分异构体;
3)若该有机物能与金属钠反应放出H2,且该有机物不能发生催化氧化反应,写出该有机物的命名。
答案
高二 化学选修五、选修三(专题一)
一、选择题(每小题2分,共40分;每小题只有一个正确选项)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | B | A | D | B | D | C | A | A | D |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| C | A | C | A | A | A | C | C | B | A |
二、选择题(本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
| 21 | 22 | 23 | 24 | 25 |
| B | CD | BD | A | C |
三、填空题:(共35分)
26、(3分)(4)(3)(1)(2)(5)
![]() 27、(8分)⑴HO-CH2CHO ⑵ CO(NH2)2 ⑶ C8H8O -OH
27、(8分)⑴HO-CH2CHO ⑵ CO(NH2)2 ⑶ C8H8O -OH
28、(3分)CO(g)+FeO(s) == Fe(s)+CO2(g) △H=―218.0kJ/mol
29、(6分)(1)Al(1分)(2)负极:4Al―12e-=4Al3+(2分)
正极:3O2+6H2O+12e― =12OH―(2分) (3)增大(1分)
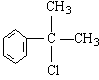
30、(15分)(1)(各2分)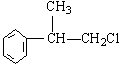 、
、
(2)加成;消去;水解或取代(各1分)
(3)(2分)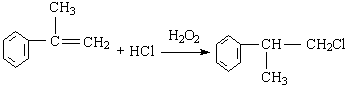
(4)(2分)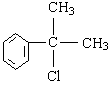 的水解产物
的水解产物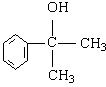 不能经氧化反应⑥而得到产品(或A中
不能经氧化反应⑥而得到产品(或A中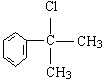 的水解产物
的水解产物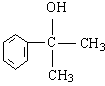 中的—OH不在链端,不能氧化成—CHO)(其他合理答案均可给分)
中的—OH不在链端,不能氧化成—CHO)(其他合理答案均可给分)
(5)(各2分)
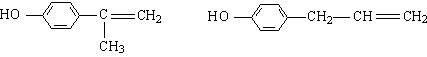
(或 ![]() 或
或 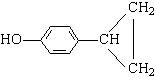
、四、计算题(共10分)
31、90%
32、1)C4H10O
2)(任选两种)
![]() CH3-CH2-CH2-CH2-OH CH3-CH2-CH-CH3
CH3-CH2-CH2-CH2-OH CH3-CH2-CH-CH3
CH3-O-CH2CH2CH3 CH3-CH2-O-CH2CH3
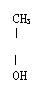 | 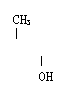 | ||
![]() CH3-C-CH3 CH3-O-CH-CH3 CH2-CH-CH2
CH3-C-CH3 CH3-O-CH-CH3 CH2-CH-CH2
3)2-甲基-2-丙醇