高二化学上学期统一考试试题
化学试题
时限:100分钟 满分:110分 2008。3。21
选择题(每小题只有一个正确答案。每小题3分,共72分)
1.下列过程不属于化学变化的是
A.石油分馏B.烧菜用过的铁锅,经常出现红棕色斑迹
 C.用明矾净化水 D.煤的气化
C.用明矾净化水 D.煤的气化
2.能一次区分CH3COOH、CH3CH2OH、 、 四种物质的是
A. H2O B. Na2CO3稀溶液 C. 酚酞溶液 D. NaOH溶液
3.能与KOH的醇溶液发生消去反应的是
![]()
![]() A.(CH3)3CCH2Cl
B.CH3Cl C. Br D. CH2Br
A.(CH3)3CCH2Cl
B.CH3Cl C. Br D. CH2Br
|
A.pH=1的溶液中:Fe2+、Al3+、HCO3—、MnO4—
B.某无色溶液中:K+、NO3—、Cl-、NH4+
C.含有大量OH-的溶液中:Na+、Cu2+、AlO2—、SO42—
D.常温下由水电离出的c(H+)=10-10 mol·L-1的溶液中:Na+、C1-、S2-、SO32—
5.“不粘锅”炊具是在金属锅的内壁上涂一薄层聚四氟乙烯制成的,下列各项对聚四氟乙烯的叙述中,正确的是
A.在聚四氟乙烯的单体中不含碳碳双键 B.聚四氟乙烯在高温时容易燃烧
C.聚四氟乙烯的化学性质很稳定 D.聚四氟乙烯的分子内支链很多
6.主链含5个碳原子,有甲基、乙基各1个支链的烷烃有
 A.2种
B.3种
C.4种
D.5种
A.2种
B.3种
C.4种
D.5种
7.下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠
溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)
A.溴乙烷 B.乙醇 C.己烷 D.苯乙烯
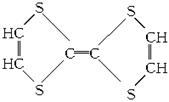
8.用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分M的结构如图所示。下列说法正确的是
A. 1 mol该烯烃最多可与3 mol Br2发生加成反应 B.它不是有机化合物
C.它是高分子化合物 D.其燃烧产物是CO2、S和H2O
9. 萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2-硝基萘,则化合物(Ⅲ)的名称应是
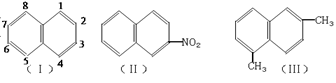
A.2,6-二甲基萘 B.1,4-二甲基萘 C.4,7-二甲基萘 D.1,6-二甲基萘
10.在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是1,5—二硝基萘 和1,8—二硝基萘的混合物。后者可溶于质量分数大于98%的硫酸而前者不能。利用这一性质可以将这两种同分异构体分离。将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8—二硝基萘,应采用的方法是
A.蒸发浓缩结晶 B.向滤液中加水后过滤
C.用Na2CO3(aq)处理滤液 D.将滤液缓缓加入水中后过滤
11.已知裂化汽油与直馏汽油的主要成分如下表:
| 裂化汽油 | 直馏汽油 |
| 烷烃、烯烃 | 烷烃、环烷烃、芳香烃 |
能把溴从溴水中萃取出来,且上层为水层可选用的萃取剂是
A.酒精 B.直馏汽油 C.裂化汽油 D.四氯化碳
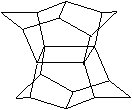 12.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。
12.1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子。
如下图分子,因其形状像东方塔式庙宇(pagoda—style temple),
所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是
A.分子式为C20H20 B.一氯代物的同分异构体只有两种
C.分子中含有二个亚甲基(—CH2—) D.分子中含有4个五元碳环
13.分子式为C5H12O的有机物,它的同分异构体中,经氧化可生成醛的有
A.4种 B.3种 C.2种 D.5种
14.为检验某卤代烃(R—X)中的X元素,有下列实验操作:①加热煮沸②加入AgNO3溶液;③取少量卤代烃④加入稀硝酸酸化⑤加入NaOH溶液⑥冷却。正确操作的先后顺序是
A.③①⑤⑥②④ B.③②①⑥④⑤ C.③⑤①⑥④② D.③⑤①⑥②④
15.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
16.一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2。则下列说法中正确的是
A.通CO的一极是电池的正极 B.负极电极反应是:O2+2CO2+4e—=2CO32—
C.熔融盐中CO32—的物质的量在工作时保持不变 D.正极发生氧化反应
17.氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是
A.“另一种反应物”具有还原性 B.CuH既可做氧化剂也可做还原剂
C.CuH+Cl2====CuCl+HCl↑(燃烧) D.CuH+HCl====CuCl+H2↑(常温)
18.关于小苏打水溶液的表述正确的是
A.c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3)
B.c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C.HCO3- 的电离程度大于HCO3-的水解程度
D.溶液中存在的电离只有:NaHCO3=Na++HCO3—和HCO3— ![]() H++CO32
H++CO32
19.在100℃时,将甲醇、甲烷、氧气的混合气体放入一装有过量Na2O2固体的密闭容器中,不断用电火花引燃,充分反应后,测得密闭容器内气体压强为零,则原混合气体中甲醇、甲烷、氧气的体积比可能是 A. 1:1:1 B. 1:2:1 C. 1:3:2 D. 无法计算
20. 2008年北京残奥会吉祥物是一牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。下列有关说法不正确的是
A.牛式二烯炔醇含有3种官能团,每个分子中有3个手性碳原子
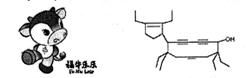 B.牛式二烯炔醇可使酸性高锰酸钾溶液褪色
B.牛式二烯炔醇可使酸性高锰酸钾溶液褪色
C.1mol牛式二烯炔醇最多可与6molBr2发生加成反应
D.牛式二烯炔醇分子内能发生消去反应
21.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
C(Na+)>c (Ac-)>c (Cl-)>c (H+)>c (HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1< b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
c(Na+)-c(F-) < c(K+)-c(CH3COO-)
22.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2 ②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO—CH2—CH2—OH中,符合题意的是
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合
23.将铁片和铜片用导线连接置于同一浓硝酸溶液中,下列各叙述正确的是
A.铁片上发生氧化反应Fe – 3e- == Fe3+ B.铜片上发生还原反应 2H++2e- =H2
C.铜片上发生氧化反应 Cu–2e- == Cu2+ D.溶液中NO3-的浓度基本不变
24.有人认为CH2 = CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2 = CH一端碳原子结合,第二步才是Br-与另一端碳原子结合。根据该观点如果让CH2 = CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
|
|
|
|
|
|
|
|
|
|
|
|
|
25.( 10分)(1)下表是A、B二种有机物的有关信息;
| A | B |
| ①能使含溴的四氯化碳溶液褪色;
③能与水在一定条件下反应 | ①由C、H两种元素组成;
|
根据表中信息回答下列问题:
①A与含溴的四氯化碳溶液反应的生成物的名称叫做 ;写出在一定条件下,A生成高分子化合物的化学反应方程式__ _____。
② A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同 分异构体。
③ B具有的性质是 (填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(2)二噁英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为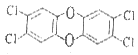 ,它的分子式为_________________,它__________属于芳香族化合物(填“是”或“否”)
,它的分子式为_________________,它__________属于芳香族化合物(填“是”或“否”)
(3)写出2-氯-2-甲基丁烷在一定条件下与NaOH醇溶液反应的化学方程式:
26.(14分)今有2H2+O2===2H2O反应,构成燃料电池,该燃料电池是一种高效、低污染的新型电池,主要用于航天领域。它的电极材料一般为活性电极,具有很强的催化活性,如铂电极、活性炭电极等。该电池以H2为燃料,O2为氧化剂,可用酸性电解质(如稀H2SO4),也可用碱性电解质(如KOH)。还可用固体氧化物作电解质(如ZrO2 、Y2O3等)。
(1)当用酸性电解质时,电极反应为:负极: 正极:
(2)当用碱性电解质时,电极反应式为:负极: 正极:
(3)用固体氧化物作电解质时,电极反应式为:负极: 正极:
(4)如把H2改CH4 ,KOH作导电物质则电极反应为:负极
正极 总反应式
 。
。
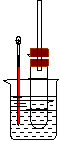
27. (6分)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产 物。某同学依据溴乙烷的性质,用右图实验装置(铁架台、酒精灯略)验证
取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
(1)用水浴加热而不直接用酒精灯加热的原因是
___________________ ___。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是生成的气体,检验的方法是
(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
28. (8分)假设空气中含有五分之一体积的氧气,且能够全部参加燃烧反应,本题所涉及和求算的气体体积都是在101℃、1.05×105Pa 条件下的体积。
某常温下为气态的烯烃A混入空气后,当平均相对分子质量达到28.9375时正好使该烯烃完全燃烧。现有甲、乙两种混合气体各89.00L,甲是上述烯烃A 与过量空气的混合气体,乙是上述烯烃A、某常温下为气态的炔烃B与过量空气的混合气体。将甲、乙分别引燃完全燃烧,乙燃烧后的气体气体变为90.00L。
(1) A的分子式为__________;(2) 甲混合气体燃烧后的体积为____________;
(3) 通过计算求出乙中炔烃的分子式和体积。 (4) 求出乙气体中含A 的最大体积。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| A | B | C | B | C | A | A | A | D | D | D | A |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| A | C | C | C | C | A | B | D | B | D | C | B |
![]() 25.(10分)(方程式2分,其它每空1分)
25.(10分)(方程式2分,其它每空1分)
![]() (1) 1,2-二溴乙烷
(1) 1,2-二溴乙烷
(2) 4 (3)②③
(2)![]() ,是
,是
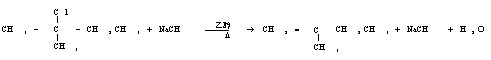
或 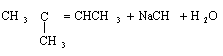
26 (14分)
(1) (2分) 2H2-4e=4H+ O2+4H++4e=2H2O
(2) (2分)2H2+4OH- -4e=4H2O O2+2H2O+4e-=4OH-
(3)(4分) 2H2 - 4e- +2O2-= 2H2O O2 + 4e-= 2O2-
(4)(6分)CH4+10OH- -8e=CO32-+7H2O 2O2+4H2O+8e=8OH-
CH4+2O2+2KOH=K2CO3 +3H2O(
27.(每空2分)(1)溴乙烷沸点低,减少溴乙烷的损失(2)试管内溶液静置后不分层
(3) 将生成的气体先通过盛有水的试管,再通入盛有KMnO4溶液的试管,KMnO4溶液褪色(或直接通入溴的四氯化碳溶液)
28.(8分)
(1)C2H4 (1分) (2)89.00 (1分) (3) B为C4H6 (1分) 体积为 2L (2分)
解法一:2C4H6 +11O2 → 8CO2 +6H2O △V
2 11 8 6 1
a b 90.00-89.00 a=2 b=11
解法二:设B为CmH2m-2,体积为XL
CmH2m-2+![]() O2
→ m CO2+
(m-1)H2O △V
O2
→ m CO2+
(m-1)H2O △V
1 ![]() m (m-1)
m (m-1) ![]()
x 90.00-89.00 (m-3)x=2
且2≤m≤4 ∴m=4 x=2
(4) A 与燃烧A所需的空气的体积共为89-2-11×5=32(L) (1分)
设A为y升
C2H4 +3O2 → 2CO2+ 2H2O
y 3y y+3y×5=32 16y=32 y=2(L) (2分)
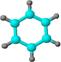 ②球棍模型为:
②球棍模型为: