高二化学上学期过关卷
化学试卷
考试时间:100分钟
第Ⅰ卷(选择题 共48分)
可能用到的数据:H—1 O—16 Na—23 Fe—56 S—32 Ag—108
一、选择题(本小题包括8小题,每小题3分,共24分,每题只有一个正确选项)
1.下列物质按纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是( )
A.纯盐酸、水煤气、硫酸、醋酸、干冰
B.冰醋酸、玻璃、硫酸钡、氢氟酸、乙醇
C.单甘油酯、冰水混合物、苛性钠、氢硫酸、三氧化硫
D.绿矾、漂白粉、次氯酸、氯化钾、氯气
2.下列描述中,不符合生产实际的是 ( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀铜,用铜作阳极
3. 在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为Amol/L与Bmol/L,则A和B的关系为 ( )
A.A>B B.A=10-4B C.B=10-4A D.A=B
4. 在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
![]()
![]()
![]() A.NH4+
+2H2O NH3·H2O + H3O+ B.HCO3-
+ H2O H3O+ + CO32-
A.NH4+
+2H2O NH3·H2O + H3O+ B.HCO3-
+ H2O H3O+ + CO32-
C.HS-+H+═ H2S D.Cl2+H2O H++Cl-+HClO
5. 25℃时,由水电离出c(H+)=1×10-9 mol/L 的溶液中,一定能大量共存的离子组是 ( )
A.Al3+、NH4+、SO42-、Cl- B.Mg2+、K+、SO42-、HCO3-
C.K+、Na+、Cl-、SO42_ D.Ba2+、Cl-、Na+、SO42-
6. 已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是: ( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
7、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为
Ag2O + Zn + H2O 2Ag + Zn(OH)2,此电池放电时负极上发生反应的物质是
A、Ag B、Zn(OH)2 C、Ag2O D、Zn
8. 对于难溶盐MX,其饱和溶液中M![]() 和X
和X![]() 的物质的量浓度之间的关系类似于c(H
的物质的量浓度之间的关系类似于c(H![]() )×c(OH
)×c(OH![]() ) = Kw , 存在等式c(M
) = Kw , 存在等式c(M![]() )×c(X
)×c(X![]() ) = Ksp。现将足量AgCl的分别放入下列物质中,AgCl的溶解度大小的排列顺序是
) = Ksp。现将足量AgCl的分别放入下列物质中,AgCl的溶解度大小的排列顺序是
1 20ml 0.01mol/L KCl溶液 2 30ml 0.02mol/L CaCl2溶液
3 40ml 0.03mol/L HCl溶液 4 10ml蒸馏水 5 50ml 0.05mol/L AgNO3溶液
A. 1>2>3>4>5 B. 4>1>3>2>5
C. 5>4>2>1>3 D. 4>3>5>2>1
二、选择题(本小题包括6小题,每小题4分,共24分,每题有一个或两个正确选项)
9. 甲酸的下列性质中,不可以证明它是弱电解质的是 ( )
A.1 mol·L-1甲酸溶液的pH值约为2
B.甲酸能与水以任何比例互溶
C.10mL1 mol·L-1甲酸与10 mL1 mol·L-1NaOH溶液完全反应后,溶液呈碱性
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱
10.某原电池总反应离子方程式为 2Fe3++Fe=3Fe2+ ,不能实现该反应的原电池是 A.正极为铜,负极为铁,电解质溶液为FeCl3 溶液 ( )
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3 溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
11、在蒸发皿中加热蒸干下列物质的溶液后再充分灼烧(低于400℃),可以得到该物质固体的是
A、硫酸镁 B、小苏打 C、氯化铁 D、亚硫酸钠
12. 常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A. pH>7, 且c(OH![]() )>c(Na
)>c(Na![]() )>c(H
)>c(H![]() )>c(CH3COO
)>c(CH3COO![]() )
)
B. pH>7, 且c(Na![]() )+ c(H
)+ c(H![]() ) =c(CH3COO
) =c(CH3COO![]() )+ c(OH
)+ c(OH![]() )
)
C. pH<7, 且c(CH3COO![]() )>c(H
)>c(H![]() )> c(Na
)> c(Na![]() )>c(OH
)>c(OH![]() )
)
D. pH=7, 且c(CH3COO![]() )>c(Na
)>c(Na![]() )> c(H
)> c(H![]() ) = c(OH
) = c(OH![]() )
)
13.重水D2O的离子积为1.6×10-15,可以用PH一样的定义来规定pD=-lgc(D+),
以下关于pD的叙述正确的是 ( )
A.中性溶液中pD=7
B.在1LD2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12
C.在1L D2O中溶解 0.01mol DCl(设溶液的体积为1L),其中pD=2
D.在100 mL 0.25mol/L 的DCl重水溶液中加入50 mL 0.2 mol/L的 NaOD的重水溶液,其中pD=1(体积变化忽略不记)
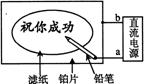 14.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
14.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A.铅笔端作阳极,发生还原反应
B.铂片端作阳极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
第Ⅱ卷(非选择题 共72分)
三、(本题包括3小题,共22分)
15.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的四处错误分别为 。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至
色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
A、转移待测液至容量瓶时,末洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读滴定管开始时仰视,读终点时俯视
16、配制FeCl2溶液时,即要加 ,其作用是 ;又要加 ,其作用
17、把AlCl3溶液蒸干后在灼烧,,最后得到的主要固体产物是 ,其理由是(用化学方程式表示,并配以必要的文字说明)
四、(本题包括2小题,共14分)
18. 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
请填写下列空白
(1)若溶液中只溶解了一种溶质,该溶质的名称是_______________,上述离子浓度大小顺序关系中正确的是_____________(填序号)
(2)若上述关系中③是正确的,则溶液中溶质是____________(填化学式)
(3)若上述关系中④是正确的,则溶液中溶质是____________(填化学式)
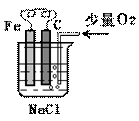 19.分析右图,按要求写出有关反应方程式:
19.分析右图,按要求写出有关反应方程式:
(1)铁棒上的电极反应式为:
(2)碳棒上的电极反应式为:
(3)溶液中发生反应的化学方程式:
五、(本题包括1小题,共13分)
。
20.下图中电极a、b分别为Ag电极和Pt电极,
电极c、d都是石墨电极。通电一段时间后,只在cd
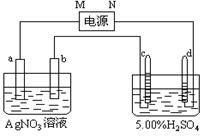 两极上共收集到336mL(标准状态)气体。回答:
两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是________,其质量为___________。C电极上的方程式
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶___∶____∶____。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同)_______,
AgNO3溶液的pH____,H2SO4溶液的浓度______,H2SO4溶液的pH______。
六、(本题包括2小题,共23分)
21.在0.5 mol/L的Na H S O3溶液中滴入石蕊溶液,溶液变红.试回答有关问题:
(1)该溶液中H S O3 离子的电离程度 (填大于,小于或等于) H S O3 离子的 水解程度.溶液中各离子的浓度由大到小的顺序为 .
(2)在Na 2S O3溶液中滴入酚酞, 溶液变红,若在溶液中再滴入过量的氯化钡溶液,所观察到的现象是 .其原因(以离子方程式和简要文字说明): .
(3)在100 mL 含等物质的量NaBr和Na H S O3 的溶液中通入0.01 molCl2 ,有1/2的Br-变为Br2(以知Br2能氧化Na H S O3)。原溶液中NaBr和Na H S O3 的浓度都等于 。
22.与c(H![]() ) × c(OH
) × c(OH![]() )= Kw 类似,FeS饱和溶液中存在FeS(S)
)= Kw 类似,FeS饱和溶液中存在FeS(S) ![]() Fe 2+ + S 2- ,
并且有c(Fe 2+) × c(S
2-) = Ksp,常温下Ksp = 8.1×10-17。
Fe 2+ + S 2- ,
并且有c(Fe 2+) × c(S
2-) = Ksp,常温下Ksp = 8.1×10-17。
(1)理论上FeS的溶解度为 。
(2)又知FeS饱和溶液中c(H![]() )与c(S 2-)存在以下限量关系:c(S 2-) × [c(H
)与c(S 2-)存在以下限量关系:c(S 2-) × [c(H![]() )] 2 = 1.0× 10-22,为了使溶液中c(Fe 2+)达到1mol/L,现将适量FeS投入其饱和溶液中,应调节溶 液中的c(H
)] 2 = 1.0× 10-22,为了使溶液中c(Fe 2+)达到1mol/L,现将适量FeS投入其饱和溶液中,应调节溶 液中的c(H![]() )为
。
)为
。